Начальная фаза гармонических колебаний происходящих. Начальная фаза колебаний. Существование электромагнитных волн вытекает из
K p = ∏ p i ν i {\displaystyle K_{p}=\prod p_{i}^{{\nu }_{i}}}
Например, для реакции окисления монооксида углерода :
2CO + O 2 = 2CO 2
константа равновесия может быть рассчитана по уравнению:
K p = p C O 2 2 p C O 2 ⋅ p O 2 {\displaystyle K_{p}={\frac {p_{CO_{2}}^{2}}{p_{CO}^{2}\cdot p_{O_{2}}}}} K p = K x P Δ n {\displaystyle K_{p}=K_{x}P^{\Delta n}}где Δn - изменение числа молей веществ в ходе реакции. Видно, что K x зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( Δ n = 0 {\displaystyle \Delta n=0} ), то K p = K x {\displaystyle K_{p}=K_{x}} .
Стандартная константа равновесия
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
K 0 = ∏ (p i ~) v i {\displaystyle K^{0}=\prod ({\tilde {p_{i}}})^{v_{i}}} где p i ~ {\displaystyle {\tilde {p_{i}}}} - относительные парциальные давления компонентов, p i ~ = p i / p i 0 {\displaystyle {\tilde {p_{i}}}=p_{i}/p_{i}^{0}} .Стандартная константа равновесия - безразмерная величина. Она связана с K p соотношением:
K p = K 0 (p i 0) Δ n {\displaystyle K_{p}=K^{0}(p_{i}^{0})^{\Delta n}}Видно, что если p i 0 {\displaystyle p_{i}^{0}} выражены в атмосферах, то (p i 0) Δ n = 1 {\displaystyle (p_{i}^{0})^{\Delta n}=1} и K p = K 0 {\displaystyle K_{p}=K^{0}} .
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям f i 0 = p i 0 {\displaystyle f_{i}^{0}=p_{i}^{0}} = 0,1013 МПа или 1 атм. K f связана с K 0 соотношением:
K f = K 0 (γ i p i 0) Δ n {\displaystyle K_{f}=K^{0}(\gamma _{i}p_{i}^{0})^{\Delta n}} где γ i - коэффициент фугитивности i-го реального газа в смеси.Константа равновесия реакций в гетерогенных системах
FeO т + CO г = Fe т + CO 2гконстанта равновесия (при условии, что газовая фаза идеальна) имеет вид:
K p = p C O 2 p C O {\displaystyle K_{p}={\frac {p_{CO_{2}}}{p_{CO}}}}Термодинамическое описание равновесия
Наряду с обозначением Q для соотношения активностей веществ в произвольный момент реакции t ("коэффициент реакции ")
Q r = { S t } σ { T t } τ { A t } α { B t } β = ∏ a j (t) ν j ∏ a i (t) ν i = ∏ a n (t) ν n {\displaystyle Q_{r}={\frac {\left\{S_{t}\right\}^{\sigma }\left\{T_{t}\right\}^{\tau }}{\left\{A_{t}\right\}^{\alpha }\left\{B_{t}\right\}^{\beta }}}={\frac {\prod a_{j(t)}^{\nu _{j}}}{\prod a_{i(t)}^{\nu _{i}}}}=\prod a_{n(t)}^{\nu _{n}}} (обозначения для приведённой ниже реакции; последнее равенство написано в обозначении, что стехиометрические коэффициент берутся со знаком "+" для продуктов и со знаком "-" для исходных веществ)в химической термодинамике используется обозначение K eq для такого же по форме соотношения между равновесными активностями веществ
K e q = [ S ] σ [ T ] τ [ A ] α [ B ] β = ∏ a j (t = ∞) ν j ∏ a i (t = ∞) ν i = ∏ a n (t = ∞) ν n {\displaystyle K_{eq}={\frac {[S]^{\sigma }[T]^{\tau }}{[A]^{\alpha }[B]^{\beta }}}={\frac {\prod a_{j(t=\infty)}^{\nu _{j}}}{\prod a_{i(t=\infty)}^{\nu _{i}}}}=\prod a_{n(t=\infty)}^{\nu _{n}}} (то есть соотношения активностей в момент t = ∞ {\displaystyle t=\infty } , в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь K eq со стандартной энергией Гиббса процесса.В системе, где протекает химическая реакция
α A + β B ⇌ σ S + τ T {\displaystyle \alpha A+\beta B\rightleftharpoons \sigma S+\tau T}равновесие может быть описано условием
(d G d ξ) T , p = 0 {\displaystyle \left({\frac {dG}{d\xi }}\right)_{T,p}=0} где ξ {\displaystyle \xi } есть химическая переменнаяили, то же самое условие равновесия может быть записано с использованием химических потенциалов как
α μ A + β μ B = σ μ S + τ μ T {\displaystyle \alpha \mu _{A}+\beta \mu _{B}=\sigma \mu _{S}+\tau \mu _{T}}где химические потенциалы
μ A = μ A ⊖ + R T ln { A } {\displaystyle \mu _{A}=\mu _{A}^{\ominus }+RT\ln\{A\}} здесь {A} - строго говоря, активность реагента A; при допущениях об идеальных газах можно заменить их на давления, для реальных газов можно заменить на фугитивности, при допущении о том, что раствор подчиняется закону Генри , можно заменить на мольные доли , и при допущении, что раствор подчиняется закону Рауля - на парциальные давления ; для системы в равновесии может быть заменена на равновесную молярную концентрацию или на равновесную активность. Δ r G o = − R T ln K e q {\displaystyle \Delta _{r}G^{o}=-RT\ln K_{eq}}Равновесный состав смеси и направление реакции
Упомянутый выше "коэффициент реакции" Q (другие обозначения, встречающиеся в литературе - Ω {\displaystyle \Omega } или π {\displaystyle \pi } , "произведение реакции")
Q r = ∏ a n (t) ν n {\displaystyle Q_{r}=\prod a_{n(t)}^{\nu _{n}}}отражает соотношение текущих активностей всех участников реакции и может быть использован для определения направления реакции в момент, для которого известен Q
Если в момент t коэффициент Q > K, то текущие активности продуктов больше равновесных, и значит они должны уменьшиться к тому моменту, когда установится равновесие, то есть в данный момент протекает обратная реакция; Если Q = K, то равновесное состояние достигнуто и скорости прямой и обратной реакций равны; Если Q < K, то v 1 > v − 1 {\displaystyle v_{1}>v_{-1}}
С использованием величины Q r {\displaystyle Q_{r}} записывается уравнение изотермы химической реакции
Δ G p , T = R T ln Q r − R T ln K e q = R T ln Q r K e q = ∑ ν i μ i {\displaystyle \Delta G_{p,T}=RT\ln Q_{r}-RT\ln K_{eq}=RT\ln {\frac {Q_{r}}{K_{eq}}}=\sum \nu _{i}\mu _{i}}Где ν {\displaystyle \nu } - стехиометрические коэффициенты (для продуктов - со знаком "+", для исходных веществ - со знаком "-"; так же, как и в выражениях для Q и K), а μ {\displaystyle \mu } - химические потенциалы а стандартная энергия Гиббса и стандартная константа суть
Δ G p , T o = − R T ln K e q o = ∑ ν i μ i o {\displaystyle \Delta G_{p,T}^{o}=-RT\ln K_{eq}^{o}=\sum \nu _{i}\mu _{i}^{o}}Где μ o {\displaystyle \mu ^{o}} - стандартные химические потенциалы
Уравнение изотермы показывает, как величина Q связана с изменением свободной энергии реакции:
При
Q
>
K
{\displaystyle Q>K}
для прямой реакции
Δ
G
>
0
{\displaystyle \Delta G>0}
, то есть
∑
ν
j
μ
j
{\displaystyle \sum \nu _{j}\mu _{j}}
для продуктов прямой реакции больше, чем для исходных веществ - это означает, что прямая реакция запрещена (значит, не запрещена обратная);
при
Q
=
K
{\displaystyle Q=K}
для прямой реакции
Δ
G
=
0
{\displaystyle \Delta G=0}
, то есть реакция достигла равновесного состояния;
при
Q
<
K
{\displaystyle Q
Величина по определению имеет смысл только для состояния равновесия, то есть для состояния с v 1 v − 1 = 1 {\displaystyle {\frac {v_{1}}{v_{-1}}}=1} и Δ G r = 0 {\displaystyle \Delta G_{r}=0} . Величина K e q {\displaystyle K_{eq}} ничего не говорит о скоростях реакций, но она описывает состав системы в состоянии равновесия.
Если K >> 1, то в системе преобладают продукты (прямой) реакции Если K << 1, то в системе преобладают исходные вещества (продукты обратной реакции)
Стандартные состояния
Стандартная энергия Гиббса реакции в газовой смеси - энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм). Стандартная энергия Гиббса реакции в растворе - энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора , но с концентрацией всех реагентов, равной единице. Для чистого вещества и жидкости стандартная энергия Гиббса совпадает с энергией Гиббса образования этих веществ. Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых имеет наибольшую по модулю отрицательную величину.
Кинетическое описание
Для обратимой химической реакции константа равновесия K eq может быть выражена через константы скорости прямых и обратных реакций. Рассмотрим элементарную обратимую химическую реакцию первого порядка
A ⇄ B {\displaystyle \mathrm {A} \rightleftarrows \mathrm {B} }По определению, равновесие задаётся условием v 1 = v − 1 {\displaystyle v_{1}=v_{-1}} , то есть равенством скоростей прямой и обратной реакций.
В соответствии с законом действующих масс v = k ∏ a j n j {\displaystyle v=k{\prod }{a_{j}}^{n_{j}}}
Где k - константа скорости соответствующей реакции, а a j n j {\displaystyle {a_{j}}^{n_{j}}} - равновесные активности реагентов этой реакции, возведённые в степени, равные их стехиометрическим коэффициентам
можно записать условие равновесия в виде
1 = v 1 v − 1 = k 1 ∏ a A n A k − 1 ∏ a B n B {\displaystyle 1={\frac {v_{1}}{v_{-1}}}={\frac {k_{1}{\prod }{a_{A}}^{n_{A}}}{k_{-1}{\prod }{a_{B}}^{n_{B}}}}} 1 = k 1 k − 1 ⋅ ∏ a A n A ∏ a B n B = k 1 k − 1 ⋅ (K e q) − 1 {\displaystyle 1={\frac {k_{1}}{k_{-1}}}\cdot {\frac {\prod {a_{A}}^{n_{A}}}{\prod {a_{B}}^{n_{B}}}}={\frac {k_{1}}{k_{-1}}}\cdot \left(K_{eq}\right)^{-1}}(см. термодинамическое описание константы равновесия), что возможно только если
K e q = k 1 k − 1 {\displaystyle K_{eq}={\frac {k_{1}}{k_{-1}}}}Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики .
Множественные равновесия
В случае, когда в системе устанавливается сразу несколько равновесий (то есть одновременного или последовательного протекает нескольких процессов), каждый из них может быть охарактеризован своей константой равновесия, из которых можно выразить общую константу равновесия для всей совокупности процессов. Можно рассмотреть такую ситуацию на примере ступенчатой диссоциации двухосновной кислоты H 2 A. Водный раствор её будет содержать частицы (сольватированные) H + , H 2 A, HA - and A 2- . Процесс диссоциации протекает в две ступени:
H 2 A ⇌ H A − + H + : K 1 = [ H A − ] [ H + ] [ H 2 A ] {\displaystyle H_{2}A\rightleftharpoons HA^{-}+H^{+}:K_{1}={\frac {}{}}} H A − ⇌ A 2 − + H + : K 2 = [ A 2 − ] [ H + ] [ H A − ] {\displaystyle HA^{-}\rightleftharpoons A^{2-}+H^{+}:K_{2}={\frac {}{}}}K 1 и K 2 - константы первой и второй ступеней диссоциации соответственно. Из них можно выразить "полную" константу равновесия, для процесса полной диссоциации :
H 2 A ⇌ A 2 − + 2 H + : K 1 + 2 = [ A 2 − ] [ H + ] 2 [ H 2 A ] = K 1 K 2 {\displaystyle H_{2}A\rightleftharpoons A^{2-}+2H^{+}:K_{1+2}={\frac {^{2}}{}}=K_{1}K_{2}}Другой пример множественного равновесия - анализ системы осадок /растворимое комплексное соединение . Допустим, имеется равновесие
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq)}Реакцию можно представить в виде двух последовательных равновесий - равновесия разложения комплексного иона на составляющие его ионы, которое характеризуется "константой нестойкости" (величина, обратная "константе устойчивости" β):
A g I 2 − (a q) ⇌ A g + (a q) + 2 I − (a q) : K 1 = α A g + α I − 2 α A g I 2 − = β − 1 {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons Ag^{+}(aq)+2I^{-}(aq):K_{1}={\frac {\alpha _{Ag^{+}}\alpha _{I^{-}}^{2}}{\alpha _{AgI_{2}^{-}}}}=\beta ^{-1}}и равновесия перехода ионов из объёма растворителя в кристаллическую решётку
A g + (a q) + I − (a q) ⇌ A g I (s o l i d) : K 2 = α A g I α A g + α I − {\displaystyle Ag^{+}(aq)+I^{-}(aq)\rightleftharpoons AgI(solid):K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}}с учётом того, что для твёрдых веществ активность принимается равной 1 , а в разбавленных растворах активности могут быть заменены на молярные концентрации, получаем
K 2 = α A g I α A g + α I − = 1 [ A g + ] [ I − ] = 1 K s p {\displaystyle K_{2}={\frac {\alpha _{AgI}}{\alpha _{Ag^{+}}\alpha _{I^{-}}}}={\frac {1}{}}={\frac {1}{K_{sp}}}}где K s p {\displaystyle K_{sp}} - произведение растворимости
Тогда суммарное равновесие будет описываться константой
A g I 2 − (a q) ⇌ A g I (s o l i d) + I − (a q) : K = α A g I α I − α A g I 2 − = K 1 ⋅ K 2 = 1 β ⋅ K s p {\displaystyle AgI_{2}^{-}(aq)\rightleftharpoons AgI(solid)+I^{-}(aq):K={\frac {\alpha _{AgI}\alpha _{I^{-}}}{\alpha _{AgI_{2}^{-}}}}=K_{1}\cdot K_{2}={\frac {1}{\beta \cdot K_{sp}}}}И значение этой константы будет условием преобладания в равновесной смеси комплексного соединения или твёрдой соли: как и выше, если K << 1, то в равновесной смеси большая часть ионов связана в комплексное соединение, если K >> 1, то в равновесном состоянии в системе большая часть ионов связана в кристаллической фазе. реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если Δ H > 0 {\displaystyle \Delta H>0} (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия d ln K p d T {\displaystyle {\frac {d\ln K_{p}}{dT}}} тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
Методы расчета константы равновесия
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (ΔG 0 ), а затем использованию формулы:
Δ G 0 = − R T ln K 0 {\displaystyle \Delta G^{0}=-RT\ln K^{0}} , где R {\displaystyle R} - универсальная газовая постоянная .При этом следует помнить, что энергия Гиббса - функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт ΔG 0 для некоторой реакции по каким-либо причинам затруднены, можно подобрать такие промежуточные реакции, для которых ΔG 0 известно или может быть легко определено, и суммирование которых даст рассматриваемую реакцию (см. Закон Гесса). В частности, в качестве таких промежуточных реакций часто используют реакции образования соединений из элементов.
Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных . Он основан на соотношении:
Δ G T = Δ H T − T Δ S T {\displaystyle \Delta G_{T}=\Delta H_{T}-T\Delta S_{T}}или, соответственно, для стандартного изменения энергии Гиббса:
Δ G T 0 = Δ H T 0 − T Δ S T 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{T}^{0}-T\Delta S_{T}^{0}}Здесь ΔH 0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны - см., например, уравнение Кирхгофа :
Δ H T 0 = Δ H 298 0 + ∫ 298 T Δ C p d T {\displaystyle \Delta H_{T}^{0}=\Delta H_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT}Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным - с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
Итак, если известны Δ H 298 0 {\displaystyle \Delta H_{298}^{0}} , Δ S 298 0 {\displaystyle \Delta S_{298}^{0}} и температурные зависимости теплоёмкости, Δ G T 0 {\displaystyle \Delta G_{T}^{0}} может быть рассчитано по формуле:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + ∫ 298 T Δ C p d T − T ∫ 298 T Δ C p d T T {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\int _{298}^{T}\Delta C_{p}dT-T\int _{298}^{T}\Delta C_{p}{\frac {dT}{T}}}Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 + Δ C p 298 (T − 298) − T ln T 298 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}+\Delta C_{p~298}(T-298)-T\ln {\frac {T}{298}}}И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Δ G T 0 = Δ H 298 0 − T Δ S 298 0 {\displaystyle \Delta G_{T}^{0}=\Delta H_{298}^{0}-T\Delta S_{298}^{0}}Переход от Δ G T 0 {\displaystyle \Delta G_{T}^{0}} к константе равновесия осуществляется по приведённой выше формуле.
Вернемся к процессу производства аммиака, выражающемуся уравнением:
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
Находясь в закрытом объеме, азот и водород соединяются и образуют аммиак. До каких пор будет протекать этот процесс? Логично предположить, что до тех пор, пока какой-либо из реагентов не закончится. Однако, в реальной жизни это не совсем так. Дело в том, что через некоторое время после того, как началась реакция, образовавшийся аммиак станет разлагаться на азот и водород, т.е., начнется обратная реакция:
2NH 3 (г) → N 2 (г) + 3H 2 (г)
Фактически в закрытом объеме будут протекать сразу две, прямо противоположные друг другу, реакции. Поэтому, данный процесс записывается таким уравнением:
N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г)
Двойная стрелка указывает на то, что реакция идет в двух направлениях. Реакция соединения азота и водорода называется прямой реакцией . Реакция разложения аммиака - обратной реакцией .
В самом начале процесса скорость прямой реакции очень велика. Но с течением времени концентрации реагентов уменьшаются, а количество аммиака возрастает - как следствие скорость прямой реакции уменьшается, а скорость обратной - возрастает. Наступает время, когда скорости прямой и обратной реакций сравниваются - наступает химическое равновесие или динамическое равновесие. При равновесии протекает как прямая, так и обратная реакции, но их скорости одинаковы, поэтому изменений не заметно.
Константа равновесия
Разные реакции протекают по-разному. В одних реакциях до момента наступления равновесия образуется довольно большое количество продуктов реакции; в других - гораздо меньше. Т.о., можно сказать, что конкретное уравнение имеет свою константу равновесия. Зная константу равновесия реакции, можно определить относительное количество реагентов и продуктов реакции, при котором наступает химическое равновесие.
Пусть некоторая реакция описывается уравнением: aA + bB = cC + dD
- a, b, c, d - коэффициенты уравнения реакции;
- A, B, C, D - химические формулы веществ.
Константа равновесия:
[C] c [D] d K = ———————— [A] a [B] b
Квадратные скобки показывают, что в формуле участвуют молярные концентрации веществ.
О чем говорит константа равновесия?
Для синтеза аммиака при комнатной температуре К=3,5·10 8 . Это довольно большое число, свидетельствующее о том, что химическое равновесие наступит когда концентрация аммиака будет намного больше оставшихся исходных веществ.
При реальном производстве аммиака задача технолога состоит в том, чтобы получить как можно бОльший коэффициент равновесия, т.е., чтобы прямая реакция прошла до конца. Каким образом этого можно добиться?
Принцип Ле Шателье
Принцип Ле Шателье гласит:
Как это понять? Все очень просто. Нарушить равновесие можно тремя способами:
- изменив концентрацию вещества;
- изменив температуру;
- изменив давление.
Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая):
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + Теплота
Меняем концентрацию
Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:

Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем количестве. Через некоторое время снова наступит химическое равновесие, но при этом концентрация азота будет больше, чем концентрация водрода:

Но, осуществить "перекос" системы в левую часть можно и другим способом - "облегчив" правую часть, например, отводить аммиак из системы по мере его образования. Т.о., снова будет преобладать прямая реакция образования аммиака.
Меняем температуру
Правую сторону наших "весов" можно изменять путем изменения температуры. Для того, чтобы левая часть "перевесила", необходимо "облегчить" правую часть - уменьшить температуру:

Меняем давление
Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить давление можно двумя способами:
- уменьшением объема системы;
- введением инертного газа.
При увеличении давления количество столкновений молекул возрастает. При этом повышается концентрация газов в системе и изменяются скорости прямой и обратной реакций - равновесие нарушается. Чтобы восстановить равновесие система "пытается" уменьшить давление.
Во время синтеза аммиака из 4-х молекул азота и водорода образуется две молекулы аммиака. В итоге количество молекул газов уменьшается - давление падает. Как следствие, чтобы придти к равновесию после увеличения давления, скорость прямой реакции возрастает.
Подведем итог. Согласно принципу Ле Шателье увеличить производство аммиака можно:
- увеличивая концентрацию реагентов;
- уменьшая концентрацию продуктов реакции;
- уменьшая температуру реакции;
- увеличивая давление при котором происходит реакция.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
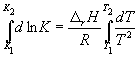 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X = 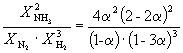 и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14),  =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
В химии равновесное состояние характеризует большинство газообразных и жидких систем, а также большую группу твердых сплавов. Поэтому закономерности химического равновесия имеют важное практическое значение. При анализе уравнения для энергии Гиббса обнаруживается, что в термодинамических системах могут возникнуть состояния, когда одновременно протекают противоположно направленные процессы, но при этом состояние системы в целом остается равновесным, т.е. ее параметры неизменны (А= 0). Неизменность параметров системы во времени, однако, является необходимым, но не достаточным условием истинного химического равновесия. При определенных условиях достаточно долго могут быть неизменными и параметры систем, в которых возможны реакции типа
Например, неизменной во времени является смесь газообразного аммиака с воздухом. Однако достаточно внести в эту смесь нагретый катализатор - оксид хрома Сг 2 О э, как начинается реакция, приводящая к образованию диоксида азота М0 2:

Расчет по уравнению Гиббса - Гельмгольца показывает, что для этой реакции AG 2 ° 98 0 и она принадлежит к реакциям типа (11.1). Значит, в данном случае мы имели дело не с истинным равновесием в системе, а только с заторможенным (метастабилъным) состоянием.
Модельной реакцией, описывающей истинно равновесные системы, будет
Конкретным примером истинно равновесной гомогенной системы является водный раствор, приготовленный из двух солей: хлорида железа(Ш) FeCl 3 и роданида калия KCNS и содержащий четыре вещества. Кроме указанных реагентов в его составе и два продукта реакции - роданид железами) Fe(CNS) 3 и хлорид калия КСЛ:
Реакции этого типа носят название кинетически-обратгшых, поскольку они протекают как в прямом, так и в обратном направлениях при любых состояниях системы. В области параметров, когда скорости прямой и обратной реакций становятся равными, система становится и термодинамически обратимой. Поэтому часто говорят об обратимости таких реакций, не уточняя, какой тип обратимости имеется в виду. Изменение энергии Гиббса в системах, где протекают реакции типа (11.1) и (11.2), могут быть представлены диаграммой (рис. 11.2).

Рис. 11.2.
На оси абсцисс диаграммы приведен состав системы (изменяется от чистых реагентов А; В в начальном (нач) состоянии, до чистых продуктов реакции П; Р в конечном (кон) состоянии) в мольных долях X, каждого компонента, а на оси ординат - величина энергии Гиббса для смеси текущего состава. Как следует из диаграммы, для реакции типа (11.1) зависимость энергии Гиббса от состава монотонна. Величина С системы по мере протекания процесса уменьшается, а величина Д,С (индекс г подчеркивает, что это изменение энергии Гиббса для химической реакции), равная разности энергий Гиббса в начальном и конечном состояниях, всегда отрицательна.
Для реакции типа (11.2) картина иная. Величина С системы на этой диаграмме имеет минимум, и вся диаграмма разбивается на две области: слева от точки Z по мере протекания процесса величина ts.fi (изменение энергии Гиббса для прямой (пр) реакции) отрицательна, а справа от точки Z по мере протекания процесса отрицательна величина А г (? обр (изменение энергии Гиббса для обратной (обр) реакции). Точка Z является точкой равновесия - в ней и А г С пр, и А; .С оГ)р равны нулю. Состав системы в точке Z называется равновесным составом. Состояние равновесия в точке Z в химической термодинамике характеризуется особой величиной - константой равнове-
СиЯ Яравн-
Константа равновесия для состояния системы при постоянной температуре есть постоянная величина. Константа равновесия может быть выражена через различные параметры системы, что отражается индексами: К с (через молярные концентрации), К х (через мольные доли), К р (через парциальные давления) и др. Алгоритм построения выражения для константы равновесия прост: она равна дроби, в числителе которой произведение равновесных параметров (концентраций, парциальных давлений, мольных долей и др.) продуктов реакции в степенях, равных стехиометрическим коэффициентам соответствующих веществ, а в знаменателе - аналогичное произведение для реагентов.
Рассмотрим выражение
![]() для модельной реакции (11.2):
для модельной реакции (11.2):
Формула вещества, заключенная в квадратные скобки, означает молярную концентрацию вещества в системе. Когда из контекста ясно, что речь идет о состоянии равновесия, индекс «равн» опускается. Особенности формы записи констант равновесия в случае гетерогенных систем будут рассмотрены в этой главе позже. Если какой-то компонент в системе представляет собой твердое тело, то его концентрация есть величина постоянная, она переносится в левую часть и включается в константу равновесия. В этом случае в аналитическом выражении такой компонент не представлен.
Аналитически константы равновесия различных типов связаны друг с другом следующим образом:
При этом каким бы образом ни выражалась К равн, она является параметром системы и не зависит от положения точки Z. Эта точка является подвижной и зависит от способа приготовления системы, что можно проверить экспериментально. Если изменить соотношение компонентов в исходном состоянии, например добавить в систему компоненты О и Е (продукты реакции), то положение точки Z сместится влево, если же добавить компоненты А и В (реагенты), то вправо. Ниже рассмотрено такое смещение положения точки равновесия системы на основании принципа Ле Шателье - Брауна.
Константы равновесия могут быть как размерными, так и безразмерными величинами. Размерность константы равновесия определяется размерностью величины, через которую она выражена (концентрация, парциальное давление и др.), и равна этой размерности в степени, равной разнице между коэффициентами конечных и начальных компонентов реакции:
![]()
Константа равновесия записывается в виде дроби, в числитель которой входят параметры продуктов реакции, а в знаменатель - параметры начальных веществ. Наиболее удобно выражать константу равновесия через мольные доли (в таком случае она не имеет размерности):
![]()
Для процессов с участием газообразных компонентов удобно выражать константу равновесия через парциальные давления газообразных компонентов:
![]()
Выражение константы равновесия через молярные концентрации удобно для процессов при постоянном объеме или в растворах (если объем растворов практически остается постоянным):
![]()
Если процесс идет без изменения числа молей (Ду = 0), то все выражения констант равновесия совпадают:
![]()
В таком случае все константы равновесия становятся безразмерными.











