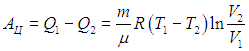Энтропия в цикле карно. Второе начало (закон) термодинамики. Энтропия. Цикл Карно. Коэффициент полезного действия тепловой машины
Для работы любой тепловой машины по замкнутому циклу необходима внешняя среда, которую условно можно представить себе как два тела - нагреватель Т mах, и холодильник , находящийся при температуре T min (T min < Т mах ). Предполагается, что при контакте с нашей системой температуры нагревателя и холодильника не меняются. При контакте с нагревателем система получает тепло, при контакте с холодильником - отдает его.
В термодинамике существует теорема Карно (рис. 5.2):
Рис. 5.2. Леонар Сади Карно (французский физик и военный инженер)
|
При заданных температурах нагревателя и холодильника максимально возможный КПД тепловой машины не зависит от природы рабочего тела машины и определяется формулой
|
Реализация максимально возможного КПД достигается в так называемом цикле Карно , когда идеальный газ проходит замкнутый цикл, составленный из двух адиабат и двух изотерм (рис. 5.3).

Рис. 5.3. Цикл Карно (обходится по часовой стрелке) - комбинация двух изотерм 1 - 2, 3 - 4 и двух адиабат 2 - 3 и 4 - 1 ; теплообмен со средой осуществляется на изотермических участках цикла: на участке 1 - 2 газ получает теплоту Q 1 , а на участке 3 - 4 отдает теплоту Q 2
Убедимся, что показанный замкнутый процесс действительно имеет КПД, соответствующий формуле (5.5). Температура системы равна T 1 в точках 1, 2 и T 2 в точках 3, 4 . Значения остальных термодинамических параметров (р, V) будут иметь в качестве индекса номер соответствующей точки на диаграмме. Нам надо вычислить количества полученной Q 1 , и отданной Q 2 теплоты, найти совершенную газом работу А Ц = Q 1 – Q 2 и определить КПД цикла. Сразу заметим, что на участках 2-3 и 4-1 система не обменивается теплом с внешней средой. Следовательно, теплоту Q 1 газ получает на участке 1-2, а теплоту Q 2 отдает на участке 3-4. Рассмотрим подробнее различные участки цикла.
Изотерма 1 -2. На этом участке газ находится в контакте с нагревателем и происходит изотермическое расширение от объема V 1 до объема V 2 . Температура Т 1 не меняется, следовательно, не изменяется внутренняя энергия, а вся полученная теплота расходуется на совершение газом работы:
![]()
Величину работы газа при изотермическом процессе мы уже вычисляли ранее, так что с учетом формулы (2.13) находим
находим
|
|
Адиабата 2 -3. Здесь система отсоединяется от нагревателя и не обменивается теплом с внешней средой: Q 23 = 0 . Газ продолжает расширяться, но уже адиабатно. Работа совершается за счет внутренней энергии газа, и его температура падает до значения Т 2 . На этом участке цикла нам нужна информация, доставляемая уравнением адиабаты :
|
|
Изотерма 3 -4. Система подключается к холодильнику, и газ начинает сжиматься. Внутренняя энергия остается неизменной, над газом совершается работа (А 34 < 0 ), а выделяющееся
![]()
передается холодильнику. Имеем аналогично (5.6)
|
|
Адиабата 4 -1. Система отключена от внешней среды и продолжает сжиматься изотермически, что приводит к повышению ее температуры до Т 1 . В конечном итоге система возвращается в первоначальное состояние. Поскольку точки 4 и 1 лежат на адиабате, получаем связь объемов и температур, аналогичную (5.7):
|
|
Из уравнений (5.7) и (5.9) находим отношения объемов

откуда следует, что
Поэтому отдаваемую холодильнику теплоту Q 2 (см. уравнение (5.8)) можно записать как
|
|
Используя выражение (5.6) для теплоты, полученной системой, находим совершенную в ходе цикла работу
|
|
Из проведенного анализа следует также, что максимальная температура в цикле равна Т mах = Т 1 , а минимальная - Т min = Т 2 . Если разделить (5.12) на (5.6), то немедленно получим выражение (5.5) для КПД цикла Карно, из которого выпадают все параметры, кроме температур холодильника и нагревателя.
Пример 1. Котел тепловой станции работает при температуре около t 1 = 550 °С . Отработанное тепло отводится к реке при температуре около t 2 = 20 °С . Найдем максимально возможный КПД этой станции (рис. 5.4).

Рис. 5.4. Схема работы тепловой машины Карно
Поскольку в формуле для КПД цикла Карно используются абсолютные температуры, надо перейти от шкалы Цельсия к шкале Кельвина: Т 1 = 550 + 273 = 823 К , Т 2 = 20 + 273 = 293 К . Теперь находим КПД тепловой станции:
![]()
Конечно, реальный КПД станции заметно ниже.
Если цикл Карно осуществить в обратном направлении, то есть против часовой стрелки на рис. 5.2, то для определения эффективности холодильной установки надо использовать формулы (5.3), (5.4) и выражения (5.6), (5.11). Получаем тогда
|
|
Печально, но чем ниже температура внешней среды Т 1 , тем меньше мы нуждаемся в холодильнике, и тем эффективнее он работает.

Рис. 5.5. Схема работы холодильной установки
Приведем численный пример. Если кондиционер поддерживает в комнате температуру t 2 = 20 °С , а температура наружного воздуха равна t 1 = 30 °С , то для холодильного коэффициента имеем

а для КПД холодильника

Конечно, на самом деле температура тепловыделяющего элемента больше наружной температуры на 20–30 градусов, так что разность температур может достигать 30–40 градусов, что приводит к значениям

Напомним, что речь идет об идеальных установках, работающих по циклу Карно. Реальный типичный кондиционер потребляет мощность 750 Вт , перекачивая за час около 5 МДж тепловой энергии. Это значит, что за секунду кондиционер совершает работу А = 750 Дж и отнимает у воздуха в комнате теплоту
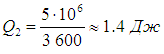
Отсюда находим
Мы видим, что реальный кондиционер гораздо менее эффективен, нежели идеальный холодильник Карно.
Пример 2. Пусть в домашнем холодильнике поддерживается температура t 2 = –3 °С (Т 2 = 270 К ), а температура в кухне равна t 1 = 27 °С (T 1 = 300 К ). Пусть далее мотор холодильника потребляет мощность N = 200 Вт . Предполагая, что холодильник работает по циклу Карно и что тепловыделяющий элемент имеет температуру окружающего воздуха, определим мощность потока тепловой энергии, перекачиваемой из камеры холодильника в кухню.
За время t мотор совершит работу
КПД холодильника равен

откуда находим количество теплоты, поступающее в кухню в единицу времени:

Обратите внимание, что холодильник работает как весьма эффективный обогреватель помещения. Надо только оплачивать потребляемую мотором мощность 200 Вт , а в кухню поступит в 10 раз большая энергия, 90 % которой перекачивается из камеры холодильника (90 % - КПД холодильника в этом примере). Любопытно, что если бы вместо холодильника был включен обогреватель той же мощности, то он нагревал бы помещение в 10 раз слабее.
Наши численные оценки можно рассматривать как пример теплового загрязнения окружающей среды, свойственного технической цивилизации.
http://eqworld.ipmnet.ru/ru/library/physics/thermodynamics.htm - Я. де Бур Введение в молекулярную физику и термодинамику, Изд. ИЛ, 1962 г. - стр. 202–205, ч. 2, гл. 2, § 10: описан процесс ожижения газа Клода - Гейландта.Второе начало термодинамики – теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому. Под теплотой понимается внутренняя энергия тела.
Рассмотрим систему, способную контактировать с двумя тепловыми резервуарами. Температуры резервуаров (нагреватель) и (холодильник) .. В первоначальном состоянии (поз. 1) температура системы . Приведем ее в тепловой контакт с нагревателем и, квазистатически уменьшив давление, увеличим объем.
Система перешла в состояние с той же температурой , но с большим объемом и меньшим давлением (поз. 2). При этом системой была выполнена работа , а нагреватель передал ей количество теплоты . Далее уберем нагреватель и квазистатически по адиабате переведем систему в состояние с температурой (поз. 3). При этом система выполнит работу . Затем приведем систему в контакт с холодильником и вказистатически уменьшим объем системы. Количество тепла , которое при этом выделит система, поглотится холодильником – ее температура останется прежней.Над системой была выполнена работа (или система выполнила отрицательную работу– ). Состояние системы (поз. 4) выбирается таким, чтобы можно было по адиабате вернуть систему в исходное состояние (поз 1). При этом система выполнит отрицательную работу Т.к. система вернулась в исходное состояние, то внутренняя энергия после цикла осталась прежней, но при этом системой была выполнена работа . Из этого следует, что изменения энергии при выполнении работы компенсировались нагревателем и холодильником. Значит ![]() , – количество теплоты, которая пошла на выполнение работы .Коэффициент полезного действия
(КПД) определяется по формуле:
, – количество теплоты, которая пошла на выполнение работы .Коэффициент полезного действия
(КПД) определяется по формуле:
![]() .
.
Отсюда следует, что .
Теорема Карно
гласит, что
коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур и нагревателя и холодильника, но не зависит от устройства машины, а также от вида рабочего вещества.
Вторая теорема Карно гласит – коэффициент полезного действия всякой тепловой машины не может превосходить коэффициент полезного действия идеальной машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника.
Неравенство Клаузиуса:
Из него видно, что количество теплоты, которое получила система при круговом процессе, отнесенное к абсолютной температуре, при которой происходил процесс, есть величина неположительная. Если процесс квазистатический, то неравенство переходит в равенство:
Это значит, что приведенное количество теплоты, получаемое системой при любом квазистатическом круговом процессе, равно нулю .
– элементарное приведенное количество теплоты, получаемое в бесконечно
малом процессе.
– элементарное приведенное количество теплоты, получаемое в конечном
процессе.
Энтропия системы есть функция ее состояния, определенная с точностью до произвольной постоянной.
Разность энтропий
в двух равновесных состояниях и , по определению, равна приведенному количеству теплоты, которое надо сообщить системе, чтобы перевести ее из состояния в состояние по любому квазистатическому пути.
Энтропия выражается функцией:
.
 Предположим, что система переходит из равновесного состояния в равновесное состояние по пути , и переход – необратимый (штрихованная). Систему в квазистатически можно вернуть в исходное состояние по другому пути . Опираясь на неравенство Клаузиуса можно написать:
Предположим, что система переходит из равновесного состояния в равновесное состояние по пути , и переход – необратимый (штрихованная). Систему в квазистатически можно вернуть в исходное состояние по другому пути . Опираясь на неравенство Клаузиуса можно написать:
В термодинамике цикл Карно́ или процесс Карно - это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов . В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой - холодильником
Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно.
Описание цикла Карно
Цикл Карно в координатах T-S
Пусть тепловая машина состоит из нагревателя с температурой , холодильника с температурой и рабочего тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две - при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
1. Изотермическое расширение (на рис. 1 - процесс A→Б). В начале процесса рабочее тело имеет температуру , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты . При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 - процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника , тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 - процесс В→Г). Рабочее тело, имеющее температуру , приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты . Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 - процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Кпд тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
Отсюда коэффициент полезного действия тепловой машины Карно равен
![]() .
.
Второе начало термодинамики: Невозможно построить периодически действующую тепловую машину, которая бы всю подводимую к ней теплоту превращала в работу, т.е. всегда .
Французский инженер Сади Карно предложил идеальный цикл, который даёт максимальное значение КПД. Этот цикл состоит из двух изотерм и двух адиабат и носит название цикла Карно .
| - изотермическое расширение при , - адиабатическое расширение , - изотермическое сжатие при , - адиабатическое сжатие . |
 Рис. 2.2 Цикл Карно в координатах (P, V).
Рис. 2.2 Цикл Карно в координатах (P, V).
Вычислим КПД цикла Карно для идеального газа. При изотермическом процессе внутренняя энергия идеального газа остаётся постоянной. Поэтому количество полученной газом теплоты равно работе , совершаемой газом при переходе из состояния 1 в состояние 2 (рис. 2.2). Эта работа равна ![]() где – масса идеального газа в тепловой машине.
где – масса идеального газа в тепловой машине.
Количество отдаваемой холодильнику теплоты равно работе , затраченной на сжатие газа при переходе его из состояния 3 в состояние 4. Эта работа равна![]() .
.
Для того, чтобы цикл был замкнутым, состояние 1 и 4 должны лежать на одной и той же адиабате. Отсюда вытекает условие:
![]() .
.
Аналогично для состояний 2 и 3 справедливо условие:
![]() .
.
Разделив одно соотношение на другое, приходим к условию замкнутости цикла :
Подставляя и в выражение для КПД, получим:
![]() . (2.2)
. (2.2)
В результате получим формулу для КПД цикла Карно:
где - температура нагревателя, - температура холодильника. КПД цикла Карно является максимальным КПД из всех возможных циклов, осуществляемых в данных температурных интервалах и .
Соотношение (2.2) составляет содержание теоремы Карно для обратимого цикла :
![]() .
.
Для необратимого цикла теорема Карно принимает вид:
![]() .
.
В общем случае можно объединить эти две записи теоремы Карно :
![]() . (2.3)
. (2.3)
Преобразуем (2.3) следующим образом:
В результате получим
Для обратимого цикла Карно: ,
для необратимого цикла Карно: .
Тогда в случае произвольного обратимого цикла можно получить:
а в случае произвольного необратимого цикла:
Соотношение (2.4) показывает, что величина, стоящая под знаком интеграла, является функцией состояния. Эта функция состояния обозначается буквой S и называется энтропией . Наряду с внутренней энергией U энтропия S играет важную роль в термодинамике.
Конец работы -
Эта тема принадлежит разделу:
Основные положения молекулярно-кинетической теории. Масса и размер молекул
М к т изучает свойства вещества давление температуру и так далее как суммарный результат действий молекул при этом пользуется статическим..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Основные положения молекулярно-кинетической теории
1. Все вещества состоят из мельчайших частиц - атомов и молекул.
2. Молекулы и атомы любого вещества находятся в непрерывном хаотическом движении, которое называется тепловым движением
Масса и размеры молекул
Для характеристики масс атомов и молекул применяются следующие величины:
Атомная масса – масса атома вещества, выраженная в а.е.м.
Молекулярная масса – масса
Термодинамические параметры и процессы. Урав-е сост-я идеального газа
Для описания состояния термодинамической системы вводятся физические величины, которые называются термодинамическими параметрами или параметрами состояния системы. Обычно в качестве термодин
Основное ур-е молекулярно-кинетической теории гага
1) Молекулы газа движутся только вдоль трех взаимно перпендикулярных направлений. Если в сосуде содержится N молекул, то в любой момент времени вдоль каждой из осей координат будет двигаться
Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия ИГ
Числом степеней свободы i системы называется количество независимых величин, с помощью которых может быть задано положение системы. Так, положение в пространстве материальной точки полностью
Максвелловское распределение энергии по степеням свободы молекул газа. Внутренняя энергия идеального газа
В случае идеального газа число молекул в единице объема, имеющих значение компоненты скорости в интервале от vx до vx + dvx может быть представ
Характерные скорости молекул газа. Опыт Штерна
1.-наиболее вероятная скорость молекул
Больцмановское распределение частиц газа по потенциальной энергии. Распределение Максвелла-Больцмана
Если газ находится во внешнем силовом поле, то частицы газа обладают потенциальной энергией eп. Распределение молекул идеального газа по высоте в однородном гравитационном поле.
Средняя длина свободного пробега молекул газа. Понятие о вакууме
Под средней длиной свободного пробега понимают среднее расстояние, которое проходит молекула между двумя последовательными соударениями.
За секунду молекула в среднем проходит расстояние,
Явление переноса: теплопроводность ИГ
Явления переноса в газах. Общие закономерности.
Беспорядочность теплового движения молекул газа, непрерывные соударения между ними приводят к постоянному перемешиванию частиц и изменению и
Диффузия и внутреннее трение в идеальном газе
Явление переноса - диффузия - заключается в самопроизвольном взаимном проникновении и перемешивании частиц двух соприкасающихся газов, жидкостей и даже твердых тел. При этом различают самодиффузию
Первое начало термодинамики. Теплоемкость ИГ. Работа газа при изменении его объема
Первое начало термодинамики:
Количество теплоты, сообщённое газу, идёт на приращение внутренней энергии газа и на совершенигазом работы над внешними телами.
Термодинамика изохорического процесса: V=const
Рассмотрим закон, описывающий этот процесс, и его график в координатах (P,V). Этот закон является частным случаем уравнения Менделеева-Клапейрона (уравнения состояния идеального газа)
Термодинамика изотермического процесса: T=const
Приведем закон, описывающий этот процесс, и его график в координатах (P,V). Рассмотрев два состояния идеального газа 1 и 2, получим
Термодинамика адиабатического процесса: dQ=0
Адиабатический процесс - это процесс, протекающий без теплообмена с окружающей средой.
Поскольку dQ = 0, то первое начало термодинамики принимает вид:
Политропические процессы
Политропическими процессами называются процессы, при которых теплоемкость газа остается постоянной.
Найдем уравнение состояния идеального газа при политропическом процессе, т.е. уравнение
Энтропия и 2-е начало трмодинамики
Энтропия – это такая функция состояния, дифференциал которой определяется отношением:
Реальный газ. Уравнение Ван-дер-Ваальса и его анализ. Критическое состояние и его параметры
Реальный газ - газ, который не описывается уравнением состояния идеального газа Клапейрона - Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимоде
Положение о необратимости процессов в природе (см. § 69), указывающее направление этих процессов, представляет собой одно из общих выражений второго начала термодинамики. Более конкретную формулировку и математическое выражение второго начала можно получить из рассмотрения так называемого цикла Карно, с которым мы познакомимся, введя предварительно понятие о круговом процессе.
Круговым процессом, или циклом, называется процесс, в результате которого система, пройдя через ряд состояний, возвращается в исходное состояние. Очевидно, что на графике круговой процесс изобразится замкнутой кривой линией (рис. 138). Работа А у совершаемая при круговом
процессе, численно равна площади ограниченной этой замкнутой линией. Поясним данное утверждение, полагая для определенности, что системой является некоторая масса газа. Цикл состоит из двух последовательных процессов: расширения и сжатия газа. В соответствии с графическим представлением работы, рассмотренным в § 70 (см. рис. 135), работа А и совершаемая газом при расширении, выразится площадью фигуры эта работа положительна (см. § 69). На тех же основаниях работа совершаемая при сжатии газа, выразится площадью фигуры и будет отрицательной. Тогда работа, совершенная при круговом процессе,
![]()
и выразится разностью площадей фигур и т. е. площадью фигуры, ограниченной замкнутой линией Если круговой процесс идет по часовой стрелке , то работа будет положительной (так как если же круговой процесс идет против часовой стрелки отрицательной (так как ).

Если в результате цикла совершается некоторая работа то система, периодически повторяющая такой цикл, называется машиной.
В 1824 г. французский инженер Сади Карно теоретически рассмотрел работу идеальной тепловой машины, состоящей из одного моля идеального газа (рабочее тело), заключенного в цилиндр под поршнем, нагревателя и холодильника. Эта система периодически совершает обратимые циклы, состоящие из двух изотермических и двух адиабатических процессов (рис. 139). Стенки цилиндра и поршень абсолютно нетеплопроводны, а дно цилиндра абсолютно теплопроводно. Однако с помощью абсолютно нетеплопроводной крышки прикладываемой ко дну цилиндра, можно было сделать весь цилиндр абсолютно нетеплопроводным. Трение и тепловые потери в системе полностью отсутствуют.
Проследим за работой этой идеальной тепловой машины, получившей название цикла Карно. Изменения состояния системы будем изображать на диаграмме, а положения поршня в цилиндре - на схеме (см. рис. 139).
1. Газ находится в сжатом состоянии поршень - в положении 1. Чтобы обеспечить изотермическое расширение газа, приведем дно цилиндра в тепловой контакт с нагревателем находящимся при температуре
2. Когда газ расширится до состояния уберем нагреватель и, закрыв дно крышкой предоставим газу возможность
закончить расширение адиабатически до состояния Совершая работу по расширению, газ охладится; поэтому
3. Чтобы завершить цикл, т. е. вернуть газ в начальное состояние а поршень - в исходное положение 7, необходимо совершить внешнюю работу сжатия газа. Будем сначала сжимать газ изотермически до состояния заменив крышку холодильника X (при температуре Причем состояние 4 надо выбрать заранее, с таким расчетом, чтобы из него по адиабате 4-1 можно было перевести газ в начальное состояние 1.
4. Завершим сжатие газа до начального состояния адиабатически, заменив холодильник крышкой
Цикл закончен и может быть затем многократно повторен. На участке 1 2 газ совершил работу по изотермическому расширению, получив от нагревателя количество теплоты На участке газ совершил работу по адиабатическому расширению за счет своей внутренней энергии. На участке 3-4 внешние силы совершили работу по изотермическому сжатию газа; при этом он отдал холодильнику количество теплоты Наконец, на участке 4 внешние силы совершили работу по адиабатическому сжатию газа, повысив его внутреннюю энергию.
Так как газ вернулся в первоначальное состояние, то изменение его внутренней энергии Тогда, согласно первому началу термодинамики [формула (1)], полученное газом в результате всего цикла количество теплоты должно равняться совершенной им за время цикла работе:
Нетрудно показать, что по абсолютной величине Действительно, оба адиабатических процесса осуществлялись в одном и том же интервале температур Тогда, согласно формуле (13), будут одинаковыми и совершаемые при этих процессах работы. Поэтому формула (14) примет вид
где - суммарная работа, совершаемая за весь цикл и численно равная площади 1234, ограниченной графиком цикла. Так как цикл проводился по часовой стрелке, то эта работа положительна. Итак, в результате цикла газ, получив количество теплоты от нагревателя и передав часть этого количества теплоты холодильнику, совершил внешнюю работу, равную
![]()
Зададимся вопросом: может ли рассматриваемая тепловая машина совершать работу только за счет получения количества теплоты от нагревателя, не отдавая части количества теплоты
холодильнику? Иными словами, можно ли теплоту целиком превращать в работу? Очевидно, что при отсутствии холодильника процесс можно было бы замкнуть (т. е. получить цикл) только посредством обратного процесса Площадь такого цикла, а следовательно, и совершаемая работа будут равны нулю. Таким образом, отдача части теплоты холодильнику является необходимым условием совершения работы. Но тогда, согласно формуле (16),
т. е. рассматриваемая тепловая машина не может все полученное количество теплоты целиком переводить в работу. Как показывают опыт и выводы из всей термодинамики, это невозможно не только для данной машины, но и вообще.

Невозможен механизм, который все получаемое от нагревателя количество теплоты целиком переводил бы в работу; часть этого количества теплоты должна быть отдана холодильнику.
Это утверждение является одной из формулировок второго начала термодинамики, а формулы (16) и (17) - его математическими выражениями. Таким образом, тепловая машина должна работать по схеме, представленной на рис. 140.
Воображаемый механизм, превращающий все количество теплоты в работу, называется вечным двигателем второго рода. Его осуществление дало бы человечеству неисчерпаемый источник энергии, поскольку запасы теплоты на Земле практически неограниченны. За счет одного только количества теплоты, содержащегося в воде морей и океанов можно было бы с помощью вечного двигателя второго рода приводить в движение машины всех фабрик и заводов в течение многих тысячелетий. Причем за первые 1700 лет такой «перекачки» теплоты температура воды в океане понизилась бы в среднем только на одну сотую долю кельвина.