Endring i likevektskonstanten. Likevektskonstant. Reversible og irreversible kjemiske reaksjoner
Kjemisk likevekt er en slik tilstand av reversibel kjemisk reaksjon
aA+ b B= c C+ d D,
der det ikke er noen endring i konsentrasjonene av reaktanter i reaksjonsblandingen over tid. Tilstanden for kjemisk likevekt er karakterisert konstant kjemisk likevekt :
Hvor C i– konsentrasjon av komponenter i likevekt den perfekte blandingen.
Likevektskonstanten kan også uttrykkes i form av likevektsmolfraksjoner X i komponenter:
For reaksjoner som skjer i gassfasen, er det praktisk å uttrykke likevektskonstanten i form av likevekts partialtrykk P i komponenter:
Til ideelle gasser P i = C i RT Og P i = X og P, Hvor P er derfor det totale trykket K P, K C Og K X er relatert av følgende forhold:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Likevektskonstanten er relatert til rG o kjemisk reaksjon:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Endring rG eller r F i en kjemisk reaksjon ved gitte (ikke nødvendigvis likevekt) partialtrykk P i eller konsentrasjoner C i komponenter kan beregnes ved hjelp av ligningen kjemiske reaksjonsisotermer (van't Hoff isotermer):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
I følge Le Chateliers prinsipp, hvis en ytre påvirkning utøves på et system som er i likevekt, vil likevekten skifte slik at effekten av den ytre påvirkningen reduseres. Dermed forskyver en økning i trykket likevekten mot en reduksjon i antall gassmolekyler. Tilsetning av en hvilken som helst reaksjonskomponent til en likevektsblanding forskyver likevekten mot en reduksjon i mengden av denne komponenten. En økning (eller reduksjon) i temperatur forskyver likevekten mot en reaksjon som oppstår med absorpsjon (frigjøring) av varme.
Den kvantitative avhengigheten av likevektskonstanten av temperaturen er beskrevet av ligningen kjemiske reaksjonsisobarer (van't Hoff isobarer)
![]() (9.9)
(9.9)
Og isokorer av en kjemisk reaksjon (van't Hoff isochores)
![]() . (9.10)
. (9.10)
Integrerende ligning (9.9) under forutsetningen at r H reaksjon er ikke avhengig av temperatur (som er sant i trange temperaturområder), gir:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Hvor C – integrasjonskonstant. Dermed er avhengigheten ln K P fra 1 /T må være lineær, og helningen til den rette linjen er - r H/R.
Integrasjon innen K 1 , K 2, og T 1, T 2 gir:
 (9.13)
(9.13)
 (9.14)
(9.14)
Ved å bruke denne ligningen, ved å kjenne likevektskonstantene ved to forskjellige temperaturer, kan vi beregne r H reaksjoner. Følgelig å vite r H reaksjon og likevektskonstanten ved en temperatur, kan du beregne likevektskonstanten ved en annen temperatur.
EKSEMPLER
CO(g) + 2H 2 (g) = CH 3 OH(g)
på 500 K. f G o for CO(g) og CH 3 OH(g) ved 500 K er lik –155,41 kJ. mol –1 og –134,20 kJ. mol –1 henholdsvis.
Løsning. G o reaksjoner:
r G o= f G o(CH 3 OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Eksempel 9-2. Reaksjonslikevektskonstant
lik K P = 1,64 10 –4 ved 400 o C. Hvilket totaltrykk må påføres en ekvimolar blanding av N 2 og H 2 slik at 10 % av N 2 blir til NH 3? Gasser anses som ideelle.
Løsning. La en mol N 2 reagere. Deretter
| N 2 (g) | + | 3H 2 (g) | = | 2NH 3 (g) | |
| Originalt antall | 1 | 1 | |||
| Likevektsmengde | 1– | 1–3 | 2 (Totalt: 2–2) | ||
| Likevekts molfraksjon: |
Derfor, K X = 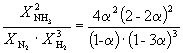 Og K P = K X . P –2
=
Og K P = K X . P –2
=  .
.
Å erstatte = 0,1 i den resulterende formelen har vi
1.64 10 –4 = , hvor P= 51,2 atm.
, hvor P= 51,2 atm.
Eksempel 9-3. Reaksjonslikevektskonstant
CO(g) + 2H 2 (g) = CH 3 OH(g)
ved 500 K er lik K P = 6,09 10 –3. En reaksjonsblanding bestående av 1 mol CO, 2 mol H 2 og 1 mol inertgass (N 2) varmes opp til 500 K og et totaltrykk på 100 atm. Beregn sammensetningen av likevektsblandingen.
Løsning. La en mol CO reagere. Deretter
| CO(g) | + | 2H 2 (g) | = | CH3OH(g) | |
| Opprinnelig mengde: | 1 | 2 | 0 | ||
| Likevektsmengde: | 1– | 2–2 | |||
| Totalt i likevektsblanding: | 3–2 mol komponenter + 1 mol N 2 = 4–2 mol | ||||
| Likevekts molfraksjon | |||||
Derfor, K X =  Og K P = K X . P–2 =
Og K P = K X . P–2 = ![]() .
.
Dermed 6,09 10 –3 = ![]() .
.
Ved å løse denne ligningen får vi = 0,732. Følgelig er molfraksjonene av stoffer i likevektsblandingen lik: = 0,288, = 0,106, = 0,212 og = 0,394.
Eksempel 9-4. For reaksjon
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
på 298 K K P = 6,0 105, a f H o(NH3) = –46,1 kJ. mol –1. Estimer verdien av likevektskonstanten ved 500 K.
Løsning. Standard molar entalpi for reaksjonen er
r H o= 2f H o(NH3) = –92,2 kJ. mol –1.
I følge ligning (9.14), 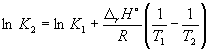 =
=
Ln (6,0 10 5) + ![]() = –1,73, hvorfra K 2 =
0.18.
= –1,73, hvorfra K 2 =
0.18.
Noter det likevektskonstant eksoterm reaksjon avtar med økende temperatur, noe som tilsvarer Le Chateliers prinsipp.
OPPGAVER
- Ved 1273 K og et totaltrykk på 30 atm i en likevektsblanding
- Ved 2000 o C og et totaltrykk på 1 atm dissosieres 2 % av vannet til hydrogen og oksygen. Regn ut likevektskonstanten for reaksjonen
- Reaksjonslikevektskonstant
- Reaksjonslikevektskonstant
- En 3-liters beholder inneholdende 1,79 10 –2 mol I 2 ble varmet opp til 973 K. Trykket i beholderen ved likevekt viste seg å være 0,49 atm. Forutsatt at gasser er ideelle, beregne likevektskonstanten ved 973 K for reaksjonen
- For reaksjon
- For reaksjon
- Et 1-liters kar inneholdende 0,341 mol PCl 5 og 0,233 mol N 2 ble varmet opp til 250 o C. Totaltrykket i karet ved likevekt viste seg å være 29,33 atm. Forutsatt at alle gasser er ideelle, beregne likevektskonstanten ved 250 o C for reaksjonen som skjer i karet
- Reaksjonslikevektskonstant
- Ved 25 o C f G o(NH 3) = –16,5 kJ. mol –1. Regne ut rG reaksjoner med dannelse av NH 3 ved partialtrykk på N 2, H 2 og NH 3 lik henholdsvis 3 atm, 1 atm og 4 atm. I hvilken retning vil reaksjonen gå spontant under disse forholdene?
- Eksoterm reaksjon
- Likevektskonstanten for gassfasereaksjonen ved isomerisering av borneol (C 10 H 17 OH) til isoborneol er 0,106 ved 503 K. En blanding av 7,5 g borneol og 14,0 g isoborneol ble plassert i en 5-liters beholder og oppbevart ved 503 K inntil likevekt ble oppnådd. Beregn molfraksjonene og massene av borneol og isoborneol i likevektsblandingen.
- Likevekt i reaksjon
- Beregn det totale trykket som må påføres en blanding av 3 deler H 2 og 1 del N 2 for å oppnå en likevektsblanding som inneholder 10 % NH 3 i volum ved 400 o C. Likevektskonstant for reaksjonen
- Ved 250 o C og et totaltrykk på 1 atm dissosieres PCl 5 med 80 % av reaksjonen
- Ved 2000 o C for reaksjon
- Regne ut standard entalpi reaksjon som likevektskonstanten er for
a) øker med 2 ganger, b) synker med 2 ganger når temperaturen endres fra 298 K til 308 K. - Avhengigheten av likevektskonstanten til reaksjonen 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) av temperatur mellom 300 K og 600 K er beskrevet av ligningen
CO 2 (g) + C(tv) = 2CO(g)
inneholder 17 % (volum) CO 2 . Hvor stor prosentandel av CO 2 vil være inneholdt i gassen ved et totalt trykk på 20 atm? Ved hvilket trykk vil gassen inneholde 25 % CO 2?
H 2 O (g) = H 2 (g) + 1/2 O 2 (g) under disse forholdene.
CO(g) + H 2 O(g) = CO 2 (g) + H 2 (g)
ved 500 o C er lik Kp= 5,5. En blanding bestående av 1 mol CO og 5 mol H 2 O ble oppvarmet til denne temperaturen. Beregn molfraksjonen av H 2 O i likevektsblandingen.
N 2 O 4 (g) = 2NO 2 (g)
ved 25 o C er lik Kp= 0,143. Beregn trykket som vil bli etablert i et kar med et volum på 1 liter, hvor 1 g N 2 O 4 ble plassert ved denne temperaturen.
I2(g) = 2I(g).
ved 250 oC rG o = –2508 J mol –1. Ved hvilket totaltrykk vil omdannelsesgraden av PCl 5 til PCl 3 og Cl 2 ved 250 o C være 30 %?
2HI(g) = H 2 (g) + I 2 (g)
likevektskonstant K P = 1,83 10 –2 ved 698,6 K. Hvor mange gram HI dannes når 10 g I 2 og 0,2 g H 2 varmes opp til denne temperaturen i en treliters beholder? Hva er partialtrykkene til H 2, I 2 og HI?
PCl 5 (g) = PCl 3 (g) + Cl 2 (g)
CO(g) + 2H 2 (g) = CH 3 OH(g)
ved 500 K er lik K P = 6,09 10 –3. Beregn det totale trykket som kreves for å produsere metanol i 90 % utbytte hvis CO og H2 tas i forholdet 1:2.
CO(g) + 2H 2 (g) = CH 3 OH(g)
er i likevekt ved 500 K og 10 bar. Hvis gassene er ideelle, hvordan vil følgende faktorer påvirke utbyttet av metanol: a) øke T; b) forfremmelse P; c) tilsetning av inert gass ved V= const; d) tilsetning av inert gass ved P= const; e) tilsetning av H 2 at P= konst?
2NOCl(g) = 2NO(g) + Cl 2 (g)
satt til 227 o C og et totaltrykk på 1,0 bar når partialtrykket til NOCl er 0,64 bar (til å begynne med var det bare NOCl tilstede). Regne ut r G o for reaksjon. Ved hvilket totaltrykk vil partialtrykket til Cl 2 være lik 0,10 bar?
N 2 (g) + 3H 2 (g) = 2NH 3 (g)
ved 400 o C er lik K = 1.60 10 –4 .
PCl5 (g) = PCl3 (g) + Cl2 (g).
Hva blir dissosiasjonsgraden av PCl 5 dersom N 2 tilføres systemet slik at partialtrykket av nitrogen blir 0,9 atm? Det totale trykket holdes ved 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3. En likevektsblanding av N 2, O 2, NO og inert gass ved et totalt trykk på 1 bar inneholder 80 % (volum) N 2 og 16 % O 2. Hvor mange volumprosent er NEI? Hva er partialtrykket til en inert gass?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
FOR UNGDOMSSKOLELÆRERE, PEDAGOGISKE UNIVERSITETSSTUDENTER OG SKOLEBARN I 9.–10. klasse SOM VEDTE SOM VEDTE VIET SEG TIL KJEMI OG NATURFAG
LÆREBOK · PROBLEMARBEIDER · LABORATORIEPRAKTIKK · VITENSKAPELIGE HISTORIER Å LESE
§ 3.2. Likevektskonstant
og isobarisk reaksjonspotensial
Likevektskonstanten kan lett finnes fra verdien av det isobariske potensialet, som beregnes fra tabulerte data om dannelsesentalpien og entropien til utgangsstoffene og reaksjonsproduktene
Du trenger denne formelen når du skal beregne likevektskonstanten til reaksjonen som studeres.
I denne læreboken prøver vi å ikke gi ferdige formler, men å utlede dem ved å bruke de enkleste metodene for matematisk logikk, så utledningen av denne formelen er gitt nedenfor. Etter å ha lest dette materialet, vil du bli kjent med de enkleste begrepene sannsynlighetsteori, aktiveringsentropi, etc.
Det er ikke bare aktiveringsenergien som bestemmer hastigheten på en kjemisk reaksjon. Størrelsen og formen til de reagerende molekylene og plasseringen av reaktive atomer eller deres grupper i dem spiller en stor rolle. I denne forbindelse, når to partikler kolliderer, er deres spesifikke orientering viktig, dvs. kontakten til nettopp de sentrene som er reaktive.
La oss betegne sannsynligheten for den molekylære orienteringen som kreves for interaksjon under en kollisjon med W:
Den naturlige logaritmen til verdien W multiplisert med gasskonstanten R kalles aktiveringsentropien Sa:
![]()
Fra dette uttrykket følger det:
![]()
Fra hvor, ved definisjonen av logaritmen, får vi sannsynligheten for den nødvendige orienteringen:
Jo større sannsynlighet for den nødvendige orienteringen for at reaksjonen skal skje, jo høyere er hastigheten og følgelig hastighetskonstanten, som kan skrives:
Tidligere har vi lært at hastighetskonstanten avhenger av aktiveringsenergien og temperaturen:
Dermed avhenger hastighetskonstanten av aktiveringsenergien, temperaturen og aktiveringsentropien:
![]()
La oss introdusere proporsjonalitetskoeffisienten Z og sette et likhetstegn:
Det resulterende uttrykket kalles grunnleggende ligning for kjemisk kinetikk.
Denne ligningen forklarer noen aspekter ved katalyse: en katalysator senker aktiveringsenergien til en reaksjon og øker aktiveringsentropien, det vil si at den øker sannsynligheten for riktig orientering av de reagerende partiklene for interaksjon.
Det er interessant å merke seg at aktiveringsentropi ikke bare tar hensyn til den spesifikke orienteringen til partiklene, men også varigheten av kontakten i kollisjonsøyeblikket. Hvis varigheten av kontakten mellom partikler er veldig kort, har ikke elektrontetthetene deres tid til å omfordele for å danne nye. kjemiske bindinger, og partiklene, frastøtende, divergerer i forskjellige retninger. Katalysatoren øker også varigheten av kontakten mellom de reagerende partiklene betydelig.
Et annet trekk ved den katalytiske virkningen: Katalysatoren tar overskuddsenergi fra den nydannede partikkelen, og den går ikke i oppløsning til de opprinnelige partiklene på grunn av dens høye energiaktivitet.
Du vet at likevektskonstanten er forholdet mellom hastighetskonstantene for forover- og bakreaksjonene:
![]()
La oss erstatte hastighetskonstantene for forover- og reversreaksjonene med uttrykkene for den grunnleggende ligningen for kjemisk kinetikk:

Forholdet mellom to proporsjonalitetskoeffisienter Z pr / Z arr er en konstant verdi, som vi vil legge til verdien av likevektskonstanten, og det er derfor den vil forbli konstant, som før.
Hvis du husker reglene for å operere med eksponentielle funksjoner, vil du forstå transformasjonen av formelen:
I samsvar med Hess' lov er forskjellen mellom aktiveringsenergiene til revers- og foroverreaksjonene endringen i entalpien (sørg for dette ved å tegne et entalpidiagram av reaksjonen som finner sted med frigjøring av varme, og ikke glem at i denne saken D N< 0 ):
![]()
Akkurat samme forskjell ![]() la oss betegne D S:
la oss betegne D S:
![]()
Forklar hvorfor det er et minustegn foran parentesen.
Vi får ligningen:
La oss ta logaritmer av begge sider av denne ligningen:
Hvor får vi:
Denne ligningen er så viktig for kjemi og andre naturvitenskap at mange utenlandske kjemistudenter bruker skjorter med bildet av denne formelen.
Hvis D G uttrykkes i J/mol, så har formelen formen:
Denne formelen har en funksjon: hvis likevektskonstanten bestemmes gjennom trykket til gassformige stoffer, erstattes trykket til disse stoffene i atmosfæren i uttrykket for likevektskonstanten (1 atm = 101325 Pa = 760 mm Hg).
Denne formelen tillater kjent verdi D G reaksjon, beregne likevektskonstanten og dermed finne ut sammensetningen av likevektssystemet ved en gitt temperatur. Formelen viser at jo høyere likevektskonstanten og jo flere reaksjonsprodukter (stoffer på høyre side av reaksjonsligningen) er inneholdt i likevektsreaksjonsblandingen, jo mer negativ betydning har en endring i det isobariske potensialet til reaksjonen. Og omvendt, jo lavere verdi av likevektskonstanten og jo færre reaksjonsprodukter og flere utgangsstoffer i likevektsblandingen, jo mindre er den negative verdien D G.
Når likevektskonstanten er større enn 1 og det isobariske potensialet er negativt, er det vanlig å si at likevekten forskyves mot reaksjonsproduktene, eller til høyre. Når likevektskonstanten er mindre enn 1 og det isobariske potensialet er positivt, er det vanlig å si at likevekten forskyves mot utgangsstoffene, eller til venstre.
Når likevektskonstanten er lik 1, er det isobariske potensialet lik 0. Denne tilstanden til systemet anses å være grensen mellom likevektsskiftet til høyre eller venstre. Når for en gitt reaksjon er endringen i isobarisk potensial negativ ( D G<0 ), er det vanlig å si at reaksjonen kan fortsette i foroverretningen; Hvis D G>0, sier de at reaksjonen ikke forsvinner.
Dermed,
D G<0 – reaksjonen kan finne sted (termodynamisk mulig);
D G<0 , Det K>1– balansen flyttes mot produkter, til høyre;
D G>0, Det TIL<1 – likevekten forskyves mot utgangsstoffene, til venstre.
Hvis du trenger å finne ut om reaksjonen du er interessert i er mulig (for eksempel for å finne ut om syntesen av ønsket fargestoff er mulig, om en gitt mineralsammensetning vil sintre, effekten av atmosfærisk oksygen på fargen, etc. ), er det nok å beregne for denne reaksjonen D G. Hvis endringen i isobarisk potensial viser seg å være negativ, er reaksjonen mulig og du kan blande forskjellige utgangsmaterialer for å oppnå ønsket produkt.
Les hva du må gjøre for å beregne endringen i isobarisk potensial og likevektskonstanten ved forskjellige temperaturer (beregningsalgoritme).
1. Skriv ned fra referansetabellene verdiene (for en temperatur på 298 K) av dannelsesentalpiene fra enkle stoffer D N arr. og entropi S alle stoffer skrevet i ligningen for en kjemisk reaksjon. Hvis D N arr. uttrykkes i kJ/mol, så skal de konverteres til J/mol (hvorfor?).
2. Beregn entalpiendringen i reaksjonen (298 K) som forskjellen mellom summen av dannelsesentalpiene til produktene og summen av dannelsesentalpiene til utgangsstoffene, husk de støkiometriske koeffisientene:
3. Beregn endringen i entropi i reaksjonen (298 K) som differansen mellom summen av entropiene til produktene og summen av entropiene til utgangsstoffene, husk de støkiometriske koeffisientene:
4. Lag en ligning for avhengigheten av endringen i det isobariske potensialet av endringer i entalpien til reaksjonen, entropien og temperaturen, og bytt ut de nettopp oppnådde numeriske verdiene i ligningen du kjenner D N r-sjon Og D S distrikter:
5. Beregn endringen i isobarisk potensial ved en standardtemperatur på 298 K:
6. Ved tegn D G distrikter, 298 trekke en konklusjon om muligheten for at reaksjonen skjer ved en standardtemperatur: hvis tegnet er "minus", er reaksjonen termodynamisk mulig; hvis tegnet er "pluss", er reaksjonen umulig.
7. Gjør regnestykket D G distrikter ved temperaturen T du er interessert i:
og trekke en konklusjon om hvordan en endring i temperaturen påvirker muligheten for en reaksjon. Hvis det viser seg at ved denne temperaturen har endringen i det isobariske potensialet blitt mindre positiv eller mer negativ sammenlignet med D G 298, derfor blir reaksjonen mer sannsynlig ved denne temperaturen.
8. Regn ut likevektskonstanten K fra ligningen du kjenner ved temperaturen T du er interessert i:
9. Trekk en konklusjon om skiftet i likevekt mot utgangsstoffene (K<1) или в сторону продуктов (К>1).
For å konkludere om muligheten for at en reaksjon oppstår med en negativ endring i isobarisk potensial ( D G distrikter<0 ) termodynamiske data alene er ofte utilstrekkelige. En termodynamisk mulig reaksjon kan vise seg å være kinetisk hemmet og mulig når forholdene endres (konsentrasjon av stoffer, trykk, temperatur), gjennom andre reaksjonsveier eller i nærvær av en riktig valgt katalysator.
La oss vurdere eksempelet på reaksjonen av krystallinsk jern med gassformig vann (vanndamp):
Hvordan finne ut om den termodynamiske muligheten for en reaksjon.
Denne reaksjonen er interessant fordi den viser årsakene til nedgangen i glansen til et metallprodukt og dets ødeleggelse fra korrosjon.
Først av alt velger vi de støkiometriske koeffisientene til reaksjonsligningen:
La oss skrive ned de termodynamiske dataene (temperatur 298 K) for alle deltakerne i reaksjonen fra referansetabellene:

La oss beregne endringen i entalpi i denne reaksjonen, og husk at entalpiene til enkle stoffer er lik null:

La oss uttrykke endringen i entalpi i J:
Reaksjonen er ledsaget av frigjøring av varme, Q>0, Q=+50 300 J/mol, og dette gjør det mulig å anta at den skjer spontant. Imidlertid kan man trygt si at en reaksjon er spontan bare ved tegnet på endringen i det isobariske potensialet.
La oss beregne endringen i entropi i denne reaksjonen, og ikke glemme de støkiometriske koeffisientene:

Entropien til systemet avtar som et resultat av reaksjonen, så det kan bemerkes at det oppstår en rekkefølgeøkning i systemet.
La oss nå lage en ligning for avhengigheten av endringer i isobarisk potensial på endringer i entalpi, entropi og temperatur:
La oss beregne endringen i det isobariske potensialet i reaksjonen ved en standardtemperatur på 298 K:
En høy negativ verdi av endringen i isobarisk potensial indikerer at jern ved romtemperatur kan oksideres av oksygen. Hvis du kunne få det fineste jernpulveret, ville du sett hvordan jern brenner i luft. Hvorfor brenner ikke jernprodukter, figurer, spiker osv. i luften? Beregningsresultatene viser at jern korroderer i luft, det vil si at det blir ødelagt og blir til jernoksider.
La oss nå se hvordan økende temperatur påvirker muligheten for denne reaksjonen. La oss beregne endringen i isobarisk potensial ved en temperatur på 500 K:
Vi oppnådde et resultat som viser at når temperaturen øker, blir endringen i det isobariske potensialet til reaksjonen mindre negativ. Dette betyr at med økende temperatur blir reaksjonen mindre termodynamisk sannsynlig, det vil si at likevekten i reaksjonen forskyves mer og mer mot utgangsstoffene.
Det er interessant å vite ved hvilken temperatur likevekten er like forskjøvet mot både reaksjonsproduktene og utgangsmaterialene. Dette skjer når D G r-sjon =0(likevektskonstanten er 1):
Hvor får vi det fra:
T=150300/168,2=894K, eller 621°C.
Ved denne temperaturen er det like sannsynlig at reaksjonen skjer både direkte og motsatt retning. Ved temperaturer over 621°C begynner den omvendte reaksjonen av reduksjon av Fe 3 O 4 med hydrogen å dominere. Denne reaksjonen er en av måtene å oppnå rent jern (i metallurgi reduseres jernoksider med karbon).
Ved en temperatur på 298 K:



Således, når temperaturen øker, synker likevektskonstanten.
Jernoksid Fe 3 O 4 kalles magnetitt (magnetisk jernmalm). Dette jernoksidet, i motsetning til oksidene FeO (wüstitt) og Fe 2 O 3 (hematitt), tiltrekkes av en magnet. Det er en legende om at i gamle tider fant en hyrde ved navn Magnus en veldig liten avlang rullestein, som han plasserte på overflaten av vannet i en skål med sine fete (hvorfor er dette viktig?) hender. Småsteinen druknet ikke og begynte å flyte på vannet, og uansett hvordan hyrden snudde bollen, pekte rullesteinen alltid bare i én retning. Som om det var slik kompasset ble oppfunnet, og mineralet fikk navnet sitt fra navnet til denne hyrden. Selv om kanskje magnetitt ble oppkalt etter den gamle byen Lilleasia - Magnesia. Magnetitt er hovedmalmen som jern utvinnes fra.
Noen ganger er magnetittformelen avbildet som følger: FeO Fe 2 O 3, noe som antyder at magnetitt består av to jernoksider. Dette er feil: magnetitt er et individuelt stoff.
Et annet oksid av Fe 2 O 3 (hematitt) - rød jernmalm - heter det på grunn av sin røde farge (i oversettelse fra gresk - blod). Jern er hentet fra hematitt.
FeO-oksid finnes nesten aldri i naturen og har ingen industriell betydning.
EKSEMPEL
Beregn den kjemiske likevektskonstanten for en reversibel homogen reaksjon, CO + H 2 O = CO 2 + H 2, basert på det faktum at likevektskonsentrasjonen av stoffer er:
[CO] p = 0,045 mol/l,
[H20]p = 0,064 mol/l,
[CO 2 ] p = 0,18 mol/l.
Gitt:
[CO] p = 0,045 mol/l
[H20]p = 0,064 mol/l
[CO 2 ] p = 0,18 mol/l
Løsning:
Molforholdet mellom reaksjonsproduktene er derfor 1:1
[CO 2 ] p = [H 2 ] p = 0,18 mol/l.
Basert på uttrykk (2.1) beregner vi verdien av den kjemiske likevektskonstanten:
Til x.r. = [CO 2 ] p [H 2 ] p / [CO 2 ] p [H 2 O] p = 0,18 0,18/0,045 0,064
Svar: 11,25.
2. Beregning av likevektskonsentrasjoner fra startkonsentrasjonene av reaktanter og omvendt
Eksempel 1.
En reversibel gassreaksjon fortsetter i henhold til ligningen:
CO + CI 2 = COCI 2.
Startkonsentrasjoner av reaktanter:
[CO]0 = 0,03 mol/l;
0 = 0,02 mol/l.
Etter at likevekt nådde, ble konsentrasjonen av karbonmonoksid:
[CO] p = 0,021 mol/l.
Beregn likevektskonsentrasjonene til de gjenværende stoffene og verdien av den kjemiske likevektskonstanten.
Gitt:
[CO] 0 = 0,03 mol/l
[C12]0 = 0,02 mol/l
[CO] p = 0,021 mol/l
P, p, K x. p – ?
Løsning:
Ved likevektstid var endringen i CO-konsentrasjon:
∆[CO] = [CO] 0 – [CO] p = 0,03 – 0,021 = 0,009 mol/l.
Siden molforholdet mellom stoffene som er involvert i reaksjonen er 1:1:1, er endringen i konsentrasjonen av alle stoffene den samme:
[C1 2 ] p = [C1 2 ] 0 – ∆[C1 2 ] = 0,02 – 0,009 = 0,011 mol/l,
[SOS1 2 ] p = 0,009 mol/l,
K x р = [ССО1 2 ] Р / [СО] Р [С1 2 ] р = 0,009/0,021 · 0,011 = 39.
Vi vil legge inn resultatene av beregningene i tabellen, der tegnene "+" og "–" betyr henholdsvis en økning eller reduksjon i konsentrasjonen av stoffet.
Svar:[C12]p = 0,011 mol/l; [SOC12]p = 0,009 mol/l; K x p = 39.
Eksempel 2.
Likevektskonsentrasjonene av stoffer involvert i den reversible reaksjonen 2NO + O 2 = 2NO 2 er som følger (mol/l):
P = 0,056;
[02] = 0,028;
Gitt:
P = 0,056 mol/l
P = 0,028 mol/l
P = 0,044 mol/l
0 , [О 2 ] 0 – ?
Løsning:
Startkonsentrasjonen av nitrogenoksid (IV) var 0 = 0, og endringen i likevektsøyeblikket er ∆ = 0,044 mol/l.
Molforholdet mellom NO og NO 2 i reaksjonen er 2:2 (1:1), derfor vil startkonsentrasjonen av NO være:
0 = p + 0,044 = 0,056 + 0,044 = 0,1 mol/l.
Molforholdet mellom O 2 og NO 2 er 1:2, derfor vil startkonsentrasjonen av O 2 være:
[02]0 = [02]p + 0,044/2 = 0,028 + 0,022 = 0,05 mol/l.
Beregningsresultatene er registrert i tabellen
Svar: 0 = 0,1 mol/l; [02]0 = 0,05 mol/l.
Eksempel 3.
Ammoniakksyntesereaksjonen fortsetter i henhold til ligningen ZN 2 + N 2 = 2NH 3. Startkonsentrasjonene av utgangsstoffene er like (mol/l): hydrogen – 0,05; nitrogen – 0,04: reaksjonshastighetskonstanten er 0,3. Beregn: a) den innledende reaksjonshastigheten; b) reaksjonshastigheten når ammoniakkkonsentrasjonen ble 0,02 mol/l.
Gitt:
a) [H2]0 = 0,05 mol/l
0 = 0,04 mol/l
b) = 0,02 mol/l
Løsning:
a) I samsvar med massehandlingsloven finner vi den innledende reaksjonshastigheten:
υ 0 = k 0 3 0 = 3 10 –1 3 = 1,5 10 –6 mol/l s.
b) Basert på reaksjonsligningen er molforholdet mellom hydrogen og ammoniakk 3:2. En økning i ammoniakkkonsentrasjonen med 0,02 mol/l gir en reduksjon i hydrogenkonsentrasjonen med 0,03 mol/l (0,02 – 3/2 = 0,03).
Da ammoniakkkonsentrasjonen økte med 0,02 mol/l, sank således hydrogenkonsentrasjonen til 0,02 mol/l (0,05 – 0,03 = 0,02). Molforholdet mellom nitrogen og ammoniakk er 1:2. Nitrogenkonsentrasjonen vil avta med 0,01 mol (0,02 – 1/2 = 0,01) og bli lik 0,03 mol/l (0,04 – 0,01 = 0,03). Reaksjonshastigheten vil også avta med synkende konsentrasjon av reaktanter:
υ = k 3 = 3 10 –1 3 = 7,2 10 –8 mol/l s.
Svar: a) 1,5 10 -6 mol/l s; b) 7,2 10 –8 mol/l s.
Eksempel 4.
Reaksjonen fortsetter i henhold til ligningen 2NO + O 2 = 2NO 2, en tid etter starten av reaksjonen ble konsentrasjonene av alle stoffene som deltar i reaksjonen: = 0,04 mol/l; [02] = 0,01 mol/l; = 0,02 mol/l. Beregn startkonsentrasjonene av utgangsstoffene og startreaksjonshastigheten hvis reaksjonshastighetskonstanten er k = 1.
Gitt:
0,04 mol/l
[02] = 0,01 mol/l
0,02 mol/l
0 , 0 , x 0 – ?
Løsning:
I henhold til reaksjonsligningen er molforholdet mellom NO og NO 2 2:2 (1:1).
En økning i konsentrasjonen av reaksjonsproduktet NO 2 til 0,02 mol/l forårsaket en reduksjon i NO-konsentrasjonen med 0,02 mol. Derfor var den opprinnelige konsentrasjonen av nitrogenoksid (II):
0 = +0,02 = 0,04 + 0,02 = 0,06 mol/l.
Molforholdet mellom O 2 og NO 2 er 1:2, så en økning i NO 2 -konsentrasjonen til 0,02 mol forårsaket en reduksjon i oksygenkonsentrasjonen med 0,01 mol (0,02 1/2 = 0,01). Som et resultat var den opprinnelige oksygenkonsentrasjonen:
[02]0 = [O2] + 0,01 = 0,01 + 0,01 = 0,02 mol/l.
Innledende reaksjonshastighet
υ 0 = k 0 2 0 = 1 2 = 7,2 · 10 –5 mol/l·s.
Svar: 0 = 0,06 mol/l; [02]0 = 0,02 mol/l;
x 0 = 7,2 10 –5 mol/l s.
La oss vurdere en reversibel kjemisk reaksjon av en generell type, der alle stoffer er i samme aggregeringstilstand, for eksempel væske:
aA + bB D cC+ d D,
hvor A og B er utgangsmaterialene for den direkte reaksjonen; C og D er direkte reaksjonsprodukter; a, b, c og d- støkiometriske koeffisienter.
I det første tidsøyeblikket, når konsentrasjonen av stoffene A og B er størst, vil også hastigheten på den direkte reaksjonen være størst og i henhold til massevirkningsloven er den lik.
u pr = k 1 C A a C B in (6.1)
hvor k 1 er hastighetskonstanten til fremreaksjonen.
Over tid synker konsentrasjonen av stoffene A og B, og følgelig avtar hastigheten på den direkte reaksjonen.
I det første øyeblikket av tiden er konsentrasjonen av stoffene C og D null, og følgelig er hastigheten på den omvendte reaksjonen null over tid, konsentrasjonen av stoffene C og D øker, og følgelig hastigheten på omvendt reaksjon øker også og den vil være lik
u arr = k 2 C C c C D d (6.2)
hvor k 2 er hastighetskonstanten til den reverserte reaksjonen.
I øyeblikket for å nå likevekt antar konsentrasjonene likevektsverdien, og hastighetene er lik hverandre u pr = u arr, derfor
k 1 C A a C B c = k 2 C C c C D d (6.3)
La oss flytte hastighetskonstantene til den ene siden og konsentrasjonene til den andre:
Forholdet mellom to konstante mengder er en konstant mengde, og det kalles den kjemiske likevektskonstanten:
Likevektskonstanten viser Hvor mange ganger er hastigheten på foroverreaksjonen større eller mindre enn hastigheten på den omvendte reaksjonen?
Likevektskonstant er forholdet mellom produktet av likevektskonsentrasjonene til reaksjonsproduktene, tatt i potensen av deres støkiometriske koeffisienter, og produktet av likevektskonsentrasjonene til utgangsstoffene, tatt i potensen av deres støkiometriske koeffisienter.
Verdien av likevektskonstanten avhenger av reaktantenes natur og temperatur, og avhenger ikke av konsentrasjonen i likevektsøyeblikket, siden deres forhold alltid er en konstant verdi, numerisk lik likevektskonstanten. Hvis det oppstår en homogen reaksjon mellom stoffer i løsning, er likevektskonstanten betegnet K C, og hvis mellom gasser, så K R.
hvor Р С, Р D, Р А og Р В er likevektstrykket til reaksjonsdeltakerne.
Ved å bruke Eq. Clapeyron-Mendeleev, er det mulig å bestemme forholdet mellom K R og K C
La oss flytte volumet til høyre side
p = RT, dvs. p = CRT (6,9)
La oss erstatte ligning (6.9) med (6.7) for hver reagens og forenkle
![]()
![]() , (6.10)
, (6.10)
hvor Dn er endringen i antall mol gassformige reaksjonsdeltakere
Dn = (c + d) - (a + c) (6.11)
Derfor,
K P = K C (RT) D n (6,12)
Fra ligning (6.12) er det klart at K P = K C dersom antall mol gassformige deltakere i reaksjonen ikke endres (Dn = 0) eller det ikke er gasser i systemet.
Det skal bemerkes at i tilfelle av en heterogen prosess, tas ikke konsentrasjonen av den faste eller flytende fasen i systemet i betraktning.
For eksempel likevektskonstanten for en reaksjon på formen 2A + 3B = C + 4D, forutsatt at alle stoffer er gasser og har formen
og hvis D er solid, da
Likevektskonstanten er av stor teoretisk og praktisk betydning. Den numeriske verdien av likevektskonstanten lar oss bedømme den praktiske muligheten og dybden av den kjemiske reaksjonen.
Hvis K > 1, deretter fortsetter denne reaksjonen med et betydelig utbytte av reaksjonsprodukter; hvis K > 10 4, så er reaksjonen irreversibel; hvis K< 1, то такая реакция нетехнологична; если K < 10 -4 , то такая реакция невозможна.
Når man kjenner likevektskonstanten, er det mulig å bestemme sammensetningen av reaksjonsblandingen i likevektsøyeblikket og beregne flytekonstanten til reaksjonsproduktene. Likevektskonstanten kan bestemmes ved hjelp av eksperimentelle metoder, analysere den kvantitative sammensetningen av reaksjonsblandingen i likevektsøyeblikket, eller ved å bruke teoretiske beregninger. For mange reaksjoner under standardbetingelser er likevektskonstanten en tabellverdi.
6.3. Faktorer som påvirker kjemisk likevekt. Le Chateliers prinsipp
Når en ytre påvirkning påføres systemet, forskyves den kjemiske likevekten, dvs. likevektskonsentrasjonene av utgangsstoffene og reaksjonsproduktene endres. Hvis likevektskonsentrasjonene av reaksjonsprodukter som følge av ytre påvirkning øker, så snakker de om en likevektsforskyvning til høyre (mot den direkte reaksjonen). Hvis likevektskonsentrasjonene av utgangsstoffene på grunn av ytre påvirkninger øker, så snakker de om en likevektsforskyvning til venstre (mot omvendt reaksjon).
Innflytelse ulike faktorer reflekterer skiftet i kjemisk likevekt Le Chateliers prinsipp (1884): hvis et system som er i stabil kjemisk likevekt påvirkes fra utsiden av skiftende temperatur, trykk eller konsentrasjon, så skifter den kjemiske likevekten i retningen som effekten av effekten reduseres.
Det skal bemerkes at katalysatoren ikke forskyver den kjemiske likevekten, men bare akselererer dens begynnelse.
La oss vurdere påvirkningen av hver faktor på skiftet i kjemisk likevekt for en generell reaksjon:
aA + bB = cC + d D±Q.
Effekt av endringer i konsentrasjon. I følge Le Chateliers prinsipp fører en økning i konsentrasjonen til en av komponentene i en likevektskjemisk reaksjon til et skifte i likevekt mot en intensivering av reaksjonen der den kjemiske behandlingen av denne komponenten skjer. Motsatt fører en reduksjon i konsentrasjonen av en av komponentene til et skifte i likevekten mot dannelsen av denne komponenten.
En økning i konsentrasjonen av substans A eller B forskyver således likevekten i foroverretningen; en økning i konsentrasjonen av stoff C eller D forskyver likevekten i motsatt retning; en reduksjon i konsentrasjonen av A eller B forskyver likevekten i motsatt retning; en reduksjon i konsentrasjonen av stoff C eller D forskyver likevekten i foroverretningen. (Skjematisk kan du skrive: -C A eller C B ®; -C C eller C D ¬; ¯ C A eller C B ¬; ¯ C C eller C D ®).
Effekt av temperatur. Generell regel, som bestemmer effekten av temperatur på likevekt, har følgende formulering: en økning i temperatur bidrar til et skifte i likevekt mot den endoterme reaksjonen (- Q); en reduksjon i temperatur fremmer et skifte i likevekt mot den eksoterme reaksjonen (+ Q).
Reaksjoner som oppstår uten termiske effekter forskyver ikke kjemisk likevekt når temperaturen endres. En temperaturøkning i dette tilfellet fører bare til en raskere etablering av likevekt, som ville vært oppnådd i et gitt system uten oppvarming, men over lengre tid.
Således, i en eksoterm reaksjon (+ Q), fører en økning i temperatur til et skift i likevekten i motsatt retning, og omvendt, i en endoterm reaksjon (- Q), fører en økning i temperaturen til et skift i forover retning, og en temperaturnedgang i motsatt retning. (Skjematisk kan vi skrive: ved +Q -T ¬; ¯T ®; ved -Q -T ®; ¯T ¬).
Effekt av trykk. Som erfaring viser, har trykk en merkbar effekt på forskyvningen av bare de likevektsreaksjonene der gassformige stoffer deltar, og samtidig er endringen i antall mol gassformige reaksjonsdeltakere (Dn) ikke lik null. Når trykket øker, skifter likevekten mot reaksjonen som er ledsaget av dannelsen av færre mol gassformige stoffer, og når trykket avtar, mot dannelsen av et større antall mol gassformige stoffer.
Således, hvis Dn = 0, så påvirker ikke trykket forskyvningen av den kjemiske likevekten; hvis Dn< 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Dn >0, så forskyver en økning i trykket likevekten i motsatt retning, og en trykkreduksjon forskyver den mot den fremadrettede reaksjonen. (Skjematisk kan vi skrive: ved Dn = 0 har P ingen effekt; ved Dn 0 -P ¬, ¯P ®). Le Chateliers prinsipp er anvendelig for både homogene og heterogene systemer og gir en kvalitativ karakteristikk av likevektsskiftet.
Eksempel 1. Beregn endringen i Gibbs-energien ΔG i dimeriseringsreaksjonen av nitrogendioksid 2NO 2 (g) = N 2 O 4 (g) ved standardtemperaturer på 298 K, 273 K og 373 K. Trekk en konklusjon om prosessens retning . Bestem likevektskonstantene for dimeriseringsreaksjonen av nitrogendioksid ved ovennevnte temperaturer. Bestem temperaturen der Δ G = 0. Trekk en konklusjon om retningen til denne reaksjonen over og under denne temperaturen. Termodynamiske egenskaper til komponentene:
ΔΗ° 298 S o 298
Mengde kJ/mol J/mol*K
NO 2 (g) 33,3 240,2
N204 (g) 9,6 303,8
Løsning. For en reversibel prosess:
aA (g) + bB (g) ⇄ cC (g) + dD (g)
uttrykket for likevektskonstanten K p vil være
K р =(P c C *P d D)/(P a A *P b B)
hvor P A, P B, P C, P D er likevektspartialtrykkene til gass komponentene A, B, C, D a, b, c, d - støkiometriske koeffisienter.
For prosess aA (g) + bB (og) ⇄ s C(g) +dD (g) uttrykk for likevektskonstanten
K c = (C c C *C d D)/(C a A *C b B)
hvor C A, C B, C C, C D er likevektskonsentrasjoner stoffene A, B, C, D a, b, c, d - støkiometriske koeffisienter.
I henhold til formel (1.4.1) for systemet 2NO 2 ⇄ N 2 O 4 har vi
K r =P N 2 O 4 / P 2 NO 2
Ved en standardtemperatur på 298 K bestemmes endringen i entalpien (ΔH o av reaksjonen) ved formel (1.2.2)
ΔH o reaksjon = ΔΗ° 298 N 2 O 4 - 2ΔΗ° 298 NO 2 = 9,6-2*33,5 = -57400 J.
Entropi-endring (1.3.5)
ΔS o reaksjon = S° 298 N2O4 - 2S° 298 NO2 =303,8-2* (240,2)=-176 J/mol*K
Ved å bruke Le Chateliers prinsipp, som sier at når forholdene som en reversibel reaksjon er i likevekt under endres, vil likevekten skifte mot prosessen med svekkelse av endring, forutsier vi retningen for likevektsskiftet. Verdien av ΔΗ o er negativ, derfor er formasjonsreaksjonen eksoterm (fortsetter med frigjøring av varme) og med en reduksjon i temperatur skal likevekten skifte til høyre, og med en økning i temperatur - til venstre. I tillegg, i henhold til formel (1.3.6), vel vitende om at ΔH
AG o 273; AG o 298; AG o 373 og K 273; K298; K 373
Vi beregner Gibbs energiverdi for gitte temperaturer ved å bruke formel (1.3.7):
ΔG o 298 = ΔH o - TAS o =-57400-298*(-176)=-4952J.,
ΔG o 273 =-57400-273*(-176)=-9352J:
ΔG o 373 =-57400-373*(-176)= 7129 J.
En negativ verdi på ΔG o 298 indikerer et skifte i likevekten til reaksjonen til høyre, og en høyere negativ verdi på ΔG o 273 indikerer at når temperaturen synker fra (298 til 273 K), skifter likevekten til høyre.
En positiv verdi på ΔG o 373 indikerer en endring i retningen av den spontane prosessen. Ved denne temperaturen blir den omvendte reaksjonen (skifting av likevekt til venstre) å foretrekke.
Likevektskonstantene K p og Gibbs energi ΔG o er relatert med formelen
hvor K p er likevektskonstanten for prosessen; R - gasskonstant; T- absolutt temperatur. I henhold til formel (1.4.3) har vi:
lnK 273 =- ΔG o 273 /RT=9352/8.31*273=4.12
lnK 298 = -ΔG o 298 /RT=4952/8,31*298=2
lnK 373 = -ΔG o 373 /RT=-7129/8,31*298=-2,3
verdien av K 298 og K 273 > 1 indikerer en likevektsforskyvning til høyre (sammenlign med (1.4.1)) og jo høyere verdi av likevektskonstanten er, desto større. K 373< 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
Betingelsen ΔG o reaksjon =0 tilsvarer likevektskonstanten,
lik en.
La oss beregne temperaturen T som tilsvarer denne konstanten ved å bruke formel (1.3.7):
ΔG°=ΔΗ°-TSO; O=AHo-TASo;
T Δ G =0 =ΔΗ°/ΔS°=57400/176=326,19 K
Konklusjon. Ved en temperatur på 326,19 K skjer forover- og bakreaksjoner med lik sannsynlighet, K p =1. Når temperaturen synker, vil likevekten skifte til høyre og øke til venstre.
Eksempel 2. Likevektskonstant K p for syntesereaksjonen av NH 3 i henhold til reaksjonen N 2+3 H2==2NH3 ved 623 K er lik 2,32*10-13. Beregn Kc ved samme temperatur.
Løsning. Forholdet mellom K p og K c utføres i henhold til formelen
K p = K c (RT) Δ n , (1.4.4)
Δn= n 2 - n 1 =2-4= -2, hvor n 1 og n 2 er antall mol av reagenser og produkter. Derfor,
Kc=Kp/(RT)An=0,624*10-5
Svar. K = 0,624*10-5.
Eksempel 2. Elastisiteten til dissosiasjonen av kalsiumkarbonat ved 1154 K er 80380 Pa, og ved 1164 K er den 91177 Pa. Beregn ved hvilken temperatur elastisiteten til kalsiumkarbonat-dissosiasjonen vil være lik 101325 Pa.
Løsning. Dissosiasjonsreaksjon CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g)
Herfra, av (1.4.1)
K p =P CO 2
Følgelig vil likevektskonstantene ved hver temperatur (T 1 - 1154 K; Τ = 1164 K* Τ = X) tilsvare trykket:
KTI = 80380; KT2 = 91177; K T 3 = 101325.
Avhengigheten av likevektskonstanten av temperaturen er vist ved Arrhenius-ligningen
dlnK p /dT= ΔΗ/RT 2 (1.4.5)
hvor K p er likevektskonstanten; T - temperatur, K; ΔΗ - termisk effekt av reaksjonen; R - gasskonstant.
Integrerende ligning (1.4.5) i temperaturområdet T 1 -T 2 ved Δ H = const får vi
lnK T 1 /K T 2 = ΔΗ/R(1/T 1 -1/T 2),
Hvor K T 1 og K T 2 er likevektskonstantene ved T 1 og T 2.
La oss først bestemme ΔΗ (i henhold til 1.4.6)
ΔΗ=ln(91177*8,31*1154*1164/80380*10)=140500 J/mol.
ln(101325/91177)=140500/8.31(1/1164-1/T 3)
T3 =1172 K
Svar. Ved T=1172K vil elastisiteten til kalsiumkarbonatdissosiasjonen være lik 101325 Pa.
Oppgaver
56. Dissosiasjonskonstant eddiksyre ved 298 K er det lik 1,75*10 -5. Hva er endringen i Gibbs energi for dissosiasjon av eddiksyre?
57. Finn verdien av Gibbs-energien (ΔG o 298) og likevektskonstanten K 298 for reaksjonen BaSO 4 (cr) → Ba 2+ (p) + SO 2- 4 (p).
For beregning bruk følgende data:
Stoff S o 298 J/mol*K ΔH o 298 kJ/mol 2 ^ 2^
BaS04(cr) 132,4 -1447,39
Ba 2+ (p) 9,64-533,83
SO 2-4 (p) 18,44 -904,2.
58. Finn likevektskonstanten ved 473 K for etylenhydratiseringsreaksjonen
C2H4 (g) + H2O (g) = C2H5OH (g).
Egenskapene til reagensene er tatt i tabellen. 3. Overse avhengigheten av ΔS og ΔH på temperaturen.
59. Med tanke på det ΔH o 298 Og ΔS omtrent 298 reaksjoner 4HCl + O 2 ⇄ 2H 2 O + 2Cl 2 er ikke avhengig av temperatur, finn temperaturen ved
Kp=1, og ΔGo = OM.
60. Bruk tabelldata til å beregne likevektskonstantene for følgende reaksjoner ved 298 K og ved 1000 K:
a) H 2 O (g) + CO ⇄ CO 2 + H 2
b) CO 2 + C (gr) ⇄ 2CO;
c) N2 + 3H2 ⇄ 2NH3.
Overse endringer i ΔH o og S o avhengig av temperatur.
61. For en eller annen spontan reaksjon Δ S< О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Uten å bruke beregninger, etablere tegnet ΔS o for følgende prosesser:
a) 2NH3 (g) ⇄ N2 (g) + H2 (g);
b) CO 2 (cr) ⇄ CO 2 (g);
c) 2NO (g) + 02 (g) = 2N02 (g);
d) 2H2S (g) + 302 = 2H20 (1) + 2S02 (g);
e) 2CH3OH (g) + 3O2 (g) = 4H20 (g) + 2CO2 (g).
63. I hvilke av følgende tilfeller er reaksjonen mulig ved enhver temperatur: a) ΔН°< 0, ΔS°>0; b) Δ Н°<0, ΔS°<0; в) Δ Н°>0, ΔS°> 0?
64. I hvilke av følgende tilfeller er reaksjonen umulig ved enhver temperatur: a) ΔН°> 0, ΔS°> 0; b) ΔН°>0, ΔS°<0; в) Δ Н°<0, ΔS°<0 ?
65. Hvis ΔΗ°<0 и ΔS°<0 ,
I hvilke av tilfellene kan reaksjonen gå spontant?
a)| ΔН°| > |TAS°|; b)| ΔН°| > |TΔS°| ?
66. Hva som påvirker systemet kan endre likevekten til systemene:
a) N2 (g) + 3H2 (g) ⇄ 2NH3 (g);
b) 4Fe (cr) + 3O 2 (g) ⇄ 2Fe 2 O 3 (cr);
c) SO 2 (g) + O 2 (g) ⇄ 2S03 (g).
67. I hvilken retning vil likevekten skifte når temperaturen stiger i systemene:
1) COCl2 ⇄ CO +Cl2; ΔН°=113 kJ;
2) 2CO ⇄ CO 2 + C; ΔН°=-171 kJ;
3) 2SO3 ⇄ 2SO2 + O2; ΔН°=192 kJ.
68. I hvilken retning vil likevekten skifte når trykket i systemene øker:
1) H2 (g) + S (cr) ⇄ H2S (g);
2) 2CO (g) ⇄ CO 2 (g) + C (g);
3) 4HCl (g) + O2 (g) ⇄ 2H20 (g) + 2Cl2 (g).
69. Hvordan vil likevekten til følgende reaksjoner bli påvirket:
CaCO 3 (cr) ⇄ CaO (cr) + CO 2 (g); ΔН°=178 kJ;
2CO (g) + O 2 (g) ⇄ 2CO 2; ΔН°=-566 kJ;
N 2 (g) + O 2 (g) ⇄ 2NO (g); ΔН°=180 kJ.
a) økning i temperatur,
b) økning i trykk?
70. Bruk referansedata og finn den omtrentlige verdien av temperaturen ved hvilken likevektskonstanten for reaksjonen for dannelse av vanngass
C (g) + H 2 O (g) ⇄ CO (g) + H 2 (g)
er lik 1. Overse avhengigheten av ΔH o og S o av temperaturen.
71. Likevektskonstanten K p av reaksjonen CO + Cl 2 ⇄ COCl 2 ved 600 o C er lik 1,67 * 10 -6. Beregn Kc for reaksjonen ved en gitt temperatur.
72. Elastisiteten til dissosiasjonen av magnesiumkarbonat ved 1000 K er 42189 Pa, og ved 1020 K er den 80313 Pa. Bestem den termiske effekten av reaksjonen MgCO 3 ⇄ MgO + CO 2 og temperaturen ved hvilken elastisiteten til dissosiasjonen av magnesiumkarbonat blir lik 1 Pa.











